Los derrames pleurales eosinofílicos (DPE) se asociaban a un menor riesgo de malignidad con una potencial relación causal con la presencia de aire y/o sangre en el espacio pleural. Sin embargo, ambas teorías han quedado en entredicho tras las últimas publicaciones.
ObjetivosConocer la incidencia y etiología de los DPE y comprobar si en toracocentesis sucesivas aumentan los eosinófilos en el líquido pleural (LP).
Material y métodosAnalizamos 730 muestras de LP correspondientes a 605 pacientes ingresados entre enero-2004 y diciembre-2010.
ResultadosIdentificamos 55 muestras con un DPE correspondientes a 50 pacientes (8,3%). Las etiologías más frecuentes de DPE fueron: desconocida (36%) y neoplasia (30%). No hubo diferencias significativas en la incidencia de neoplasias entre los derrames pleurales no eosinofílicos (DPNE) (25,9%) y los DPE (30%) (p=0,533). A 100 pacientes (16,5%) se les repitió la toracocentesis. De los 9 con un DPE en la primera, 6 lo mantenían en la segunda. De los 91 con un DPNE en la primera toracocentesis, 8 (8,8%) tuvieron un DPE en las sucesivas. El porcentaje de eosinófilos no aumentó en las toracocentesis sucesivas (p=0,427). En los DPE se encontró correlación significativa entre los números de hematíes y de eosinófilos en LP (r=0,563; p=0,000).
ConclusionesUn DPE no puede considerarse un indicador de benignidad por lo que debe ser estudiado como cualquier derrame pleural. La repetición de toracocentesis no parece que aumente el número de eosinófilos y, por último, la presencia de sangre en el LP podría justificar la existencia de un DPE.
Eosinophilic pleural effusion (EPE) has been associated with less risk for malignancy with a potential causal relationship with the presence of air and/or blood in the pleural space. However, these theories have fallen by the wayside in the light of recent publications.
ObjectivesTo determine the incidence and etiology of EPE and to observe whether the eosinophils in the pleural liquid (PL) increase in successive thoracocenteses.
Patients and MethodsWe analyzed 730 PL samples from 605 patients hospitalized between January 2004 and December 2010.
ResultsWe identified 55 samples with EPE from 50 patients (8.3%). The most frequent etiologies of EPE were: unknown (36%) and neoplasm (30%). There were no significant differences in the incidence of neoplasms between the non-eosinophilic pleural effusions (non-EPE) (25.9%) and the EPE (30%) (p=0.533). One hundred patients (16.5%) underwent a second thoracocentesis. Out of the 9 who had EPE in the first, 6 maintained EPE in the second. Out of the 91 with non-EPE in the first thoracocentesis, 8 (8.8%) had EPE in the repeat thoracocentesis. The percentage of eosinophils did not increase in the successive thoracocenteses (p=0.427). In the EPE, a significant correlation was found between the number of hematites and eosinophils in the PL (r=0.563; p=0.000).
ConclusionsAn EPE cannot be considered an indicator of benignancy, therefore it should be studied as any other pleural effusion. The number of eosinophils does not seem to increase with the of repetition of thoracocentesis and, lastly, the presence of blood in the PL could explain the existence of EPE.
El recuento de células nucleadas totales en el líquido pleural (LP) suele proporcionar información útil. Además de la naturaleza de la lesión pleural que se produzca, uno de los factores que influyen en el tipo de población celular existente es el tiempo de evolución del derrame. Así, los derrames pleurales con predominio de neutrófilos suelen observarse en respuestas agudas, tras un proceso infeccioso, inmunológico o inflamatorio, como las neumonías bacterianas, embolismo pulmonar o pancreatitis aguda, mientras que un predominio de linfocitos es más frecuente en derrames de más de 2 semanas de evolución, como sucede en la tuberculosis, linfomas, pleuritis reumatoideas o quilotórax1. Sin embargo, el significado clínico de los derrames pleurales eosinofílicos (DPE) es incierto2.
La literatura clásica considera que los DPE se asocian a un menor riesgo de malignidad y que existe una potencial relación causal entre la presencia de aire y/o sangre en el espacio pleural y la aparición de un DPE3,4. Sin embargo, ambas teorías han quedado en entredicho tras las últimas publicaciones que han puesto de manifiesto que los derrames neoplásicos son tan prevalentes en los DPE como en los no eosinofílicos (DPNE), y que la incidencia de DPE en los pacientes a los que se les practica una segunda toracocentesis no es diferente a la que se halla con la primera5–8.
Los objetivos de nuestro estudio son, conocer la incidencia y etiología de los DPE en nuestra población, valorar si estos derrames se asocian a malignidad con menor frecuencia que los DPNE y comprobar si las toracocentesis sucesivas producen un aumento de los eosinófilos en el LP.
Material y métodosHemos incluido de forma consecutiva a todos los pacientes ingresados entre enero de 2004 y diciembre de 2010 en el servicio de Neumología de nuestro hospital con un derrame pleural. Las muestras de LP y sangre se obtuvieron el mismo día con el paciente en ayunas. Las determinaciones bioquímicas llevadas a cabo fueron las siguientes: proteínas totales, lactato dehidrogenasa (LDH), glucosa, colesterol, número de hematíes y recuento total y porcentual de células nucleadas, tanto en LP como en plasma (P). Además, muestras de LP se enviaron también a anatomía patológica y microbiología. La biopsia pleural se llevó a cabo, indistintamente, con agujas de Cope o de Abrams.
Las determinaciones bioquímicas se realizaron con un analizador ADVIA 1650 (SIEMENS Healthcare Diagnostics S.L). Los rangos de valores normales en sangre fueron: proteínas totales: 6-8g/dL; LDH: 115-320 U/L; glucosa: 65-110mg/dL; colesterol: 115-220mg/dL. El recuento de hematíes y de células nucleadas en el LP se determinaron mediante un contador de Hematología ADVIA 2120 (SIEMENS Healthcare Diagnostics S.L). El recuento diferencial de células nucleadas se llevó a cabo tras citocentrifugación (450 x g durante 10min) y tinción de May-Grünwald-Giemsa, de forma manual para el LP y automática para la sangre.
El DPE se definió como aquel derrame pleural que contenía ≥ 10% de eosinófilos. En los casos de realizar dos o más toracocentesis en el mismo paciente, y más de una muestra de líquido pleural cumplía los criterios de DPE, solamente se tuvieron en cuenta los resultados de la primera. Aquellos pacientes a los que se les practicó una toracocentesis en Urgencias para descartar un empiema y no se les aplicó el protocolo del estudio al completo, también fueron excluidos. Los derrames pleurales se clasificaron en trasudados o exudados utilizando los criterios de Light y del colesterol pleural9,10. La etiología de los DPE se estableció en base a la historia clínica, exploración física, estudios radiológicos, hallazgos de laboratorio y el resultado del análisis del líquido y biopsia pleural. La etiología de los trasudados pleurales (insuficiencia cardiaca congestiva, hepatopatía crónica y síndrome nefrótico) se basó en los datos clínicos y de laboratorio, así como en la citología y microbiología negativa del líquido pleural11. El diagnóstico de los exudados pleurales se estableció en base a los siguientes criterios:
Derrame pleural maligno: citología positiva en el LP y/o histología de la biopsia pleural.
Derrame pleural tuberculoso: cultivo para Mycobacterium Tuberculosis en líquido o biopsia pleural, o muestras respiratorias (esputo, aspirado bronquial o lavado broncoalveolar), o bien, granulomas en la biopsia pleural.
Derrame pleural paraneumónico/empiema: pacientes con signos y síntomas típicos (síndrome febril agudo y dolor pleurítico) e infiltrados pulmonares en la radiografía de tórax, sin otra explicación para derrame pleural.
Derrames pleurales pos-traumáticos: aquellos que se desarrollaron después de un traumatismo torácico sin que existiera otra causa que lo explicara.
Derrames pleurales debidos a enfermedades del tejido conectivo: pacientes con una de estas enfermedades, después de la exclusión de otras causas de derrame pleural.
Derrames pleurales de origen desconocido: cuando todos los procedimientos diagnósticos no fueron capaces de identificar la etiología del derrame. Estos pacientes fueron seguidos para asegurarse de que el derrame pleural no recurría.
Análisis estadísticoLos datos se expresaron como mediana y rango intercuartil. Para la comparación entre los grupos a estudio se utilizó la prueba chi-cuadrado de Pearson, en caso de variables cualitativas, y la prueba no paramétrica de Mann-Whitney en el caso de las variables cuantitativas. En la comparación de las variables continuas en los mismos individuos se utilizó la prueba de Wilcoxon para datos apareados. Se consideraron significativos aquellos valores con p<0,05. Para el análisis de datos se utilizó el programa SPSS para Windows v.15.
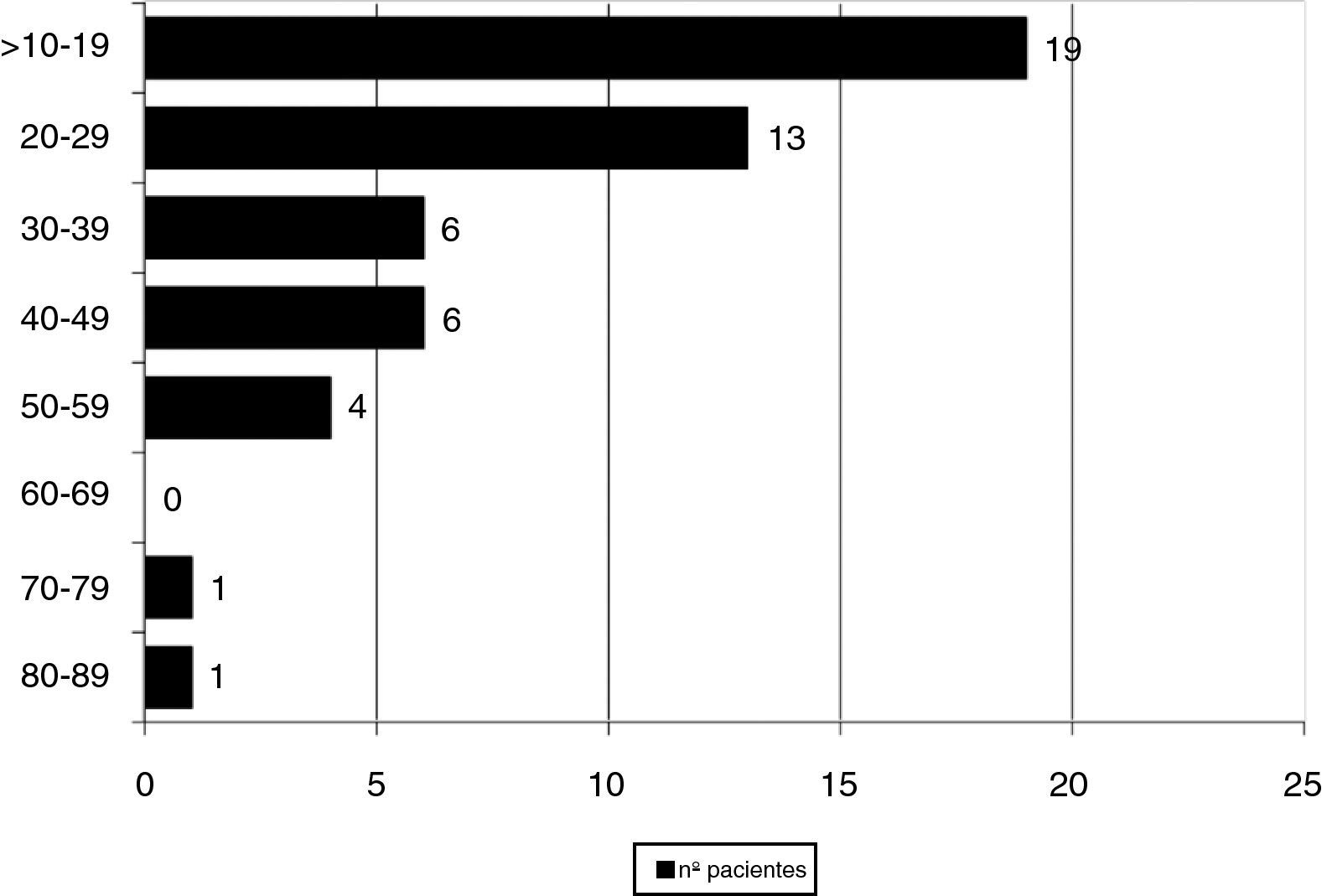
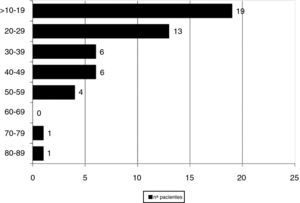
ResultadosHallamos 55 DPE en 730 muestras (7,5%) que correspondían a 50 pacientes de un total de 605 (8,3%). En la figura 1 se observa la distribución del porcentaje de eosinófilos en todos los casos con DPE.
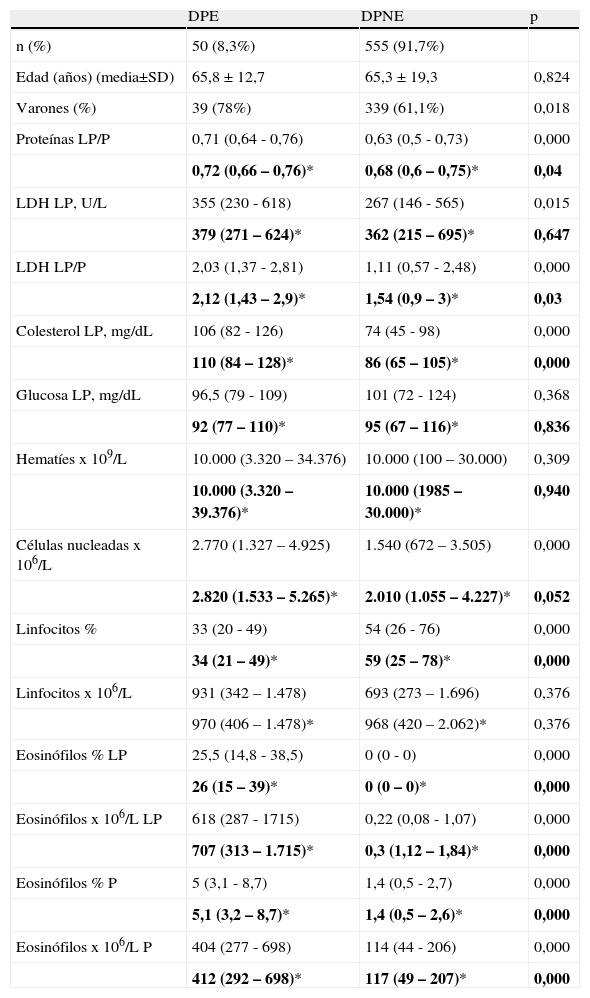
Las características de los pacientes con DPE y DPNE se expresan en la tabla 1. En los DPE el porcentaje de varones fue significativamente más elevado que en los DPNE. Igualmente, en los DPE, se encontraron valores significativamente más elevados de proteínas totales LP/S, LDH LP, LDH LP/S, Colesterol LP, células nucleadas y porcentaje y recuento de eosinófilos, tanto en LP como en S, que en los DPNE. Si se excluyen los trasudados (insuficiencia cardiaca, hepatopatía crónica, hipoalbuminemia y síndrome nefrótico) de ambos grupos (DPE y DPNE), para comprobar que esta diferencia no es debida al mayor número de trasudados en los DPNE, se siguieron observando diferencias significativas para los parámetros proteínas totales LP/P, LDH LP/P, colesterol LP y porcentaje y recuento de eosinófilos, éste último tanto en LP como en P. En los DPNE el porcentaje de linfocitos es significativamente mayor que en los DPE, tanto en la totalidad de los derrames como en los exudados.
Comparación de la edad, sexo y parámetros bioquímicos seleccionados en pacientes con «derrames pleurales eosinofílicos y derrames pleurales no eosinofílicos»
| DPE | DPNE | p | |
| n (%) | 50 (8,3%) | 555 (91,7%) | |
| Edad (años) (media±SD) | 65,8±12,7 | 65,3 ± 19,3 | 0,824 |
| Varones (%) | 39 (78%) | 339 (61,1%) | 0,018 |
| Proteínas LP/P | 0,71 (0,64 - 0,76) | 0,63 (0,5 - 0,73) | 0,000 |
| 0,72 (0,66 – 0,76)* | 0,68 (0,6 – 0,75)* | 0,04 | |
| LDH LP, U/L | 355 (230 - 618) | 267 (146 - 565) | 0,015 |
| 379 (271 – 624)* | 362 (215 – 695)* | 0,647 | |
| LDH LP/P | 2,03 (1,37 - 2,81) | 1,11 (0,57 - 2,48) | 0,000 |
| 2,12 (1,43 – 2,9)* | 1,54 (0,9 – 3)* | 0,03 | |
| Colesterol LP, mg/dL | 106 (82 - 126) | 74 (45 - 98) | 0,000 |
| 110 (84 – 128)* | 86 (65 – 105)* | 0,000 | |
| Glucosa LP, mg/dL | 96,5 (79 - 109) | 101 (72 - 124) | 0,368 |
| 92 (77 – 110)* | 95 (67 – 116)* | 0,836 | |
| Hematíes x 109/L | 10.000 (3.320 – 34.376) | 10.000 (100 – 30.000) | 0,309 |
| 10.000 (3.320 – 39.376)* | 10.000 (1985 – 30.000)* | 0,940 | |
| Células nucleadas x 106/L | 2.770 (1.327 – 4.925) | 1.540 (672 – 3.505) | 0,000 |
| 2.820 (1.533 – 5.265)* | 2.010 (1.055 – 4.227)* | 0,052 | |
| Linfocitos % | 33 (20 - 49) | 54 (26 - 76) | 0,000 |
| 34 (21 – 49)* | 59 (25 – 78)* | 0,000 | |
| Linfocitos x 106/L | 931 (342 – 1.478) | 693 (273 – 1.696) | 0,376 |
| 970 (406 – 1.478)* | 968 (420 – 2.062)* | 0,376 | |
| Eosinófilos % LP | 25,5 (14,8 - 38,5) | 0 (0 - 0) | 0,000 |
| 26 (15 – 39)* | 0 (0 – 0)* | 0,000 | |
| Eosinófilos x 106/L LP | 618 (287 - 1715) | 0,22 (0,08 - 1,07) | 0,000 |
| 707 (313 – 1.715)* | 0,3 (1,12 – 1,84)* | 0,000 | |
| Eosinófilos % P | 5 (3,1 - 8,7) | 1,4 (0,5 - 2,7) | 0,000 |
| 5,1 (3,2 – 8,7)* | 1,4 (0,5 – 2,6)* | 0,000 | |
| Eosinófilos x 106/L P | 404 (277 - 698) | 114 (44 - 206) | 0,000 |
| 412 (292 – 698)* | 117 (49 – 207)* | 0,000 |
Los datos se expresan como mediana (percentil 25 – percentil 75); *: «se excluyen los trasudados»
DPE: derrame pleural eosinofílico; DPNE: derrame pleural no eosinofílico; LDH: lactato dehidrogenasa; LP: líquido pleural; P: plasma.
La mediana del porcentaje de eosinófilos en el LP de los pacientes con un DPE fue 25,5% (14,8% - 38,5%), significativamente más alto que el porcentaje de eosinófilos en sangre periférica 5% (3,1 - 8,7%) (p=0,000). La mediana del recuento de eosinófilos en el líquido pleural de estos pacientes fue 618 células x 106/L (287 – 1.715), significativamente mayor que el de la sangre periférica 404 células x 106/L (277 - 698), p=0,000. Treinta y uno de los 50 pacientes con un DPE, tenían más de 350 eosinófilos/mm3 en sangre periférica y correspondían a 10 derrames neoplásicos, 10 no filiados, 4 pos-traumatismo, 2 paraneumónicos, 2 pos-cirugía y uno cada uno a lupus eritematoso sistémico, artritis reumatoide e insuficiencia cardiaca.
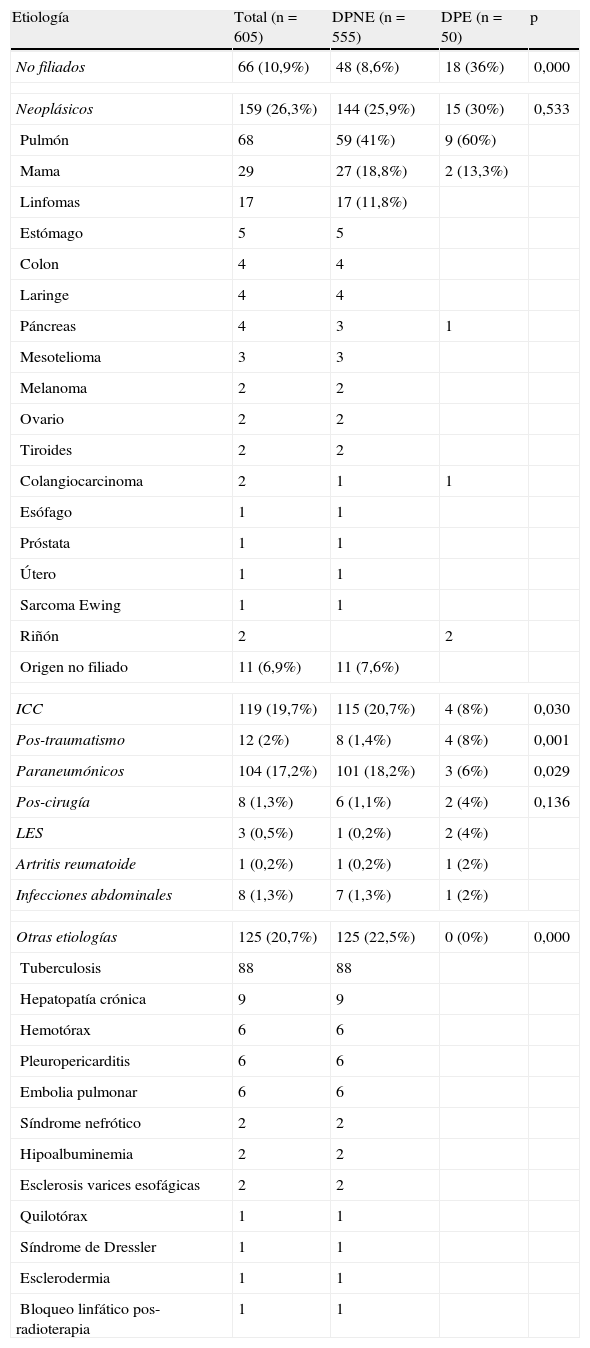
La etiología de los pacientes con DPE se indica en la tabla 2. El porcentaje de derrames pleurales de origen no filiado fue significativamente mayor en los DPE que en los DPNE (p=0,000), al igual que los pos-traumáticos (p=0,001). Por el contrario, no se encontraron diferencias significativas en el porcentaje de derrames neoplásicos entre los DPE y DPNE (p=0,533). Por último, el porcentaje de derrames por insuficiencia cardiaca y paraneumónicos fue significativamente más alto en los DPNE que en los DPE.
Etiología de los derrames pleurales eosinofílicos
| Etiología | Total (n=605) | DPNE (n=555) | DPE (n=50) | p |
| No filiados | 66 (10,9%) | 48 (8,6%) | 18 (36%) | 0,000 |
| Neoplásicos | 159 (26,3%) | 144 (25,9%) | 15 (30%) | 0,533 |
| Pulmón | 68 | 59 (41%) | 9 (60%) | |
| Mama | 29 | 27 (18,8%) | 2 (13,3%) | |
| Linfomas | 17 | 17 (11,8%) | ||
| Estómago | 5 | 5 | ||
| Colon | 4 | 4 | ||
| Laringe | 4 | 4 | ||
| Páncreas | 4 | 3 | 1 | |
| Mesotelioma | 3 | 3 | ||
| Melanoma | 2 | 2 | ||
| Ovario | 2 | 2 | ||
| Tiroides | 2 | 2 | ||
| Colangiocarcinoma | 2 | 1 | 1 | |
| Esófago | 1 | 1 | ||
| Próstata | 1 | 1 | ||
| Útero | 1 | 1 | ||
| Sarcoma Ewing | 1 | 1 | ||
| Riñón | 2 | 2 | ||
| Origen no filiado | 11 (6,9%) | 11 (7,6%) | ||
| ICC | 119 (19,7%) | 115 (20,7%) | 4 (8%) | 0,030 |
| Pos-traumatismo | 12 (2%) | 8 (1,4%) | 4 (8%) | 0,001 |
| Paraneumónicos | 104 (17,2%) | 101 (18,2%) | 3 (6%) | 0,029 |
| Pos-cirugía | 8 (1,3%) | 6 (1,1%) | 2 (4%) | 0,136 |
| LES | 3 (0,5%) | 1 (0,2%) | 2 (4%) | |
| Artritis reumatoide | 1 (0,2%) | 1 (0,2%) | 1 (2%) | |
| Infecciones abdominales | 8 (1,3%) | 7 (1,3%) | 1 (2%) | |
| Otras etiologías | 125 (20,7%) | 125 (22,5%) | 0 (0%) | 0,000 |
| Tuberculosis | 88 | 88 | ||
| Hepatopatía crónica | 9 | 9 | ||
| Hemotórax | 6 | 6 | ||
| Pleuropericarditis | 6 | 6 | ||
| Embolia pulmonar | 6 | 6 | ||
| Síndrome nefrótico | 2 | 2 | ||
| Hipoalbuminemia | 2 | 2 | ||
| Esclerosis varices esofágicas | 2 | 2 | ||
| Quilotórax | 1 | 1 | ||
| Síndrome de Dressler | 1 | 1 | ||
| Esclerodermia | 1 | 1 | ||
| Bloqueo linfático pos-radioterapia | 1 | 1 | ||
DPE: derrames pleurales eosinofílicos; DPNE: derrames pleurales no eosinofílicos; ICC: insuficiencia cardiaca congestiva; LES: lupus eritematoso sistémico.
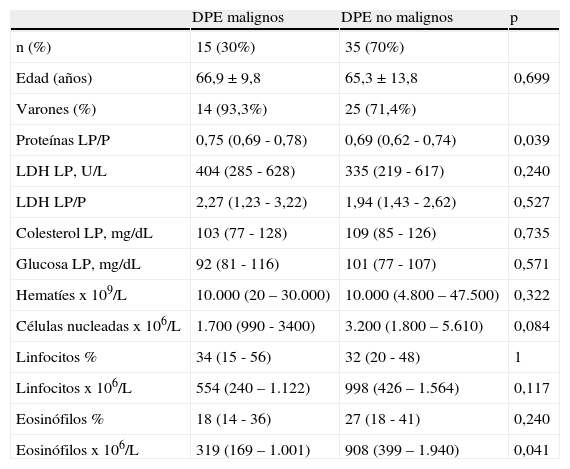
El 8% de los DPE (4/50) correspondían a trasudados por el 20,7% de los DPNE (115/555). El análisis comparativo de los pacientes con un DPE de origen maligno y no maligno se indica en la tabla 3. Es destacable que el recuento de eosinófilos fue significativamente más elevado en los DPE no malignos que en los de origen maligno (p=0,041). La capacidad diagnóstica del porcentaje de eosinófilos en LP para diferenciar, en el grupo de DPE, los derrames malignos de los no malignos, es discreta (área bajo la curva 0,61; intervalo de confianza al 95% 0,44 – 0,77). Un punto de corte de 25% de eosinófilos en LP tiene una sensibilidad del 60% y una especificidad del 63%.
Comparación entre los «derrames pleurales eosinofílicos» de origen maligno y no maligno
| DPE malignos | DPE no malignos | p | |
| n (%) | 15 (30%) | 35 (70%) | |
| Edad (años) | 66,9 ± 9,8 | 65,3 ± 13,8 | 0,699 |
| Varones (%) | 14 (93,3%) | 25 (71,4%) | |
| Proteínas LP/P | 0,75 (0,69 - 0,78) | 0,69 (0,62 - 0,74) | 0,039 |
| LDH LP, U/L | 404 (285 - 628) | 335 (219 - 617) | 0,240 |
| LDH LP/P | 2,27 (1,23 - 3,22) | 1,94 (1,43 - 2,62) | 0,527 |
| Colesterol LP, mg/dL | 103 (77 - 128) | 109 (85 - 126) | 0,735 |
| Glucosa LP, mg/dL | 92 (81 - 116) | 101 (77 - 107) | 0,571 |
| Hematíes x 109/L | 10.000 (20 – 30.000) | 10.000 (4.800 – 47.500) | 0,322 |
| Células nucleadas x 106/L | 1.700 (990 - 3400) | 3.200 (1.800 – 5.610) | 0,084 |
| Linfocitos % | 34 (15 - 56) | 32 (20 - 48) | 1 |
| Linfocitos x 106/L | 554 (240 – 1.122) | 998 (426 – 1.564) | 0,117 |
| Eosinófilos % | 18 (14 - 36) | 27 (18 - 41) | 0,240 |
| Eosinófilos x 106/L | 319 (169 – 1.001) | 908 (399 – 1.940) | 0,041 |
DPPE: derrame pleural eosinofílico; LDH: lactato dehidrogenasa; LP: líquido pleural; P: plasma.
Se llevó a cabo un seguimiento de los 18 DPE de origen no filiado. Dos pacientes se perdieron al no acudir a las consultas programadas. En 15 de los 16 casos (93,8%), el derrame pleural desapareció a los 6 meses de forma espontánea y en el otro el derrame persiste en la actualidad (a seguimiento en nuestra consulta externa). Dos de los quince casos en los que el derrame pleural desapareció, fallecieron posteriormente: ambos por infecciones de origen respiratorio.
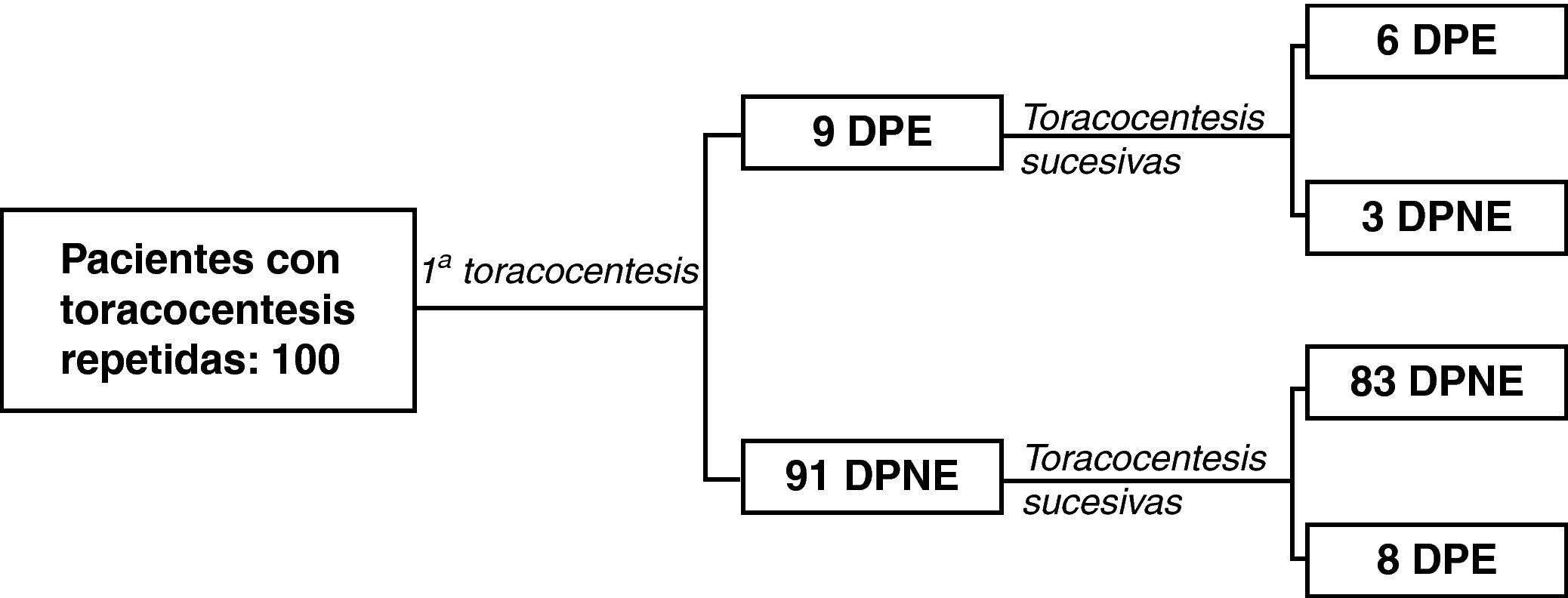
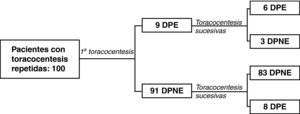
Se repitieron 125 toracocentesis a 100 de los 605 pacientes (16,5%): 9 con un DPE (9%) y 91 (91%) con un DPNE en la primera. La mediana del intervalo entre la primera y la segunda toracocentesis fue de 8 días (4 – 14). En 6 de los 9 pacientes con un DPE, el predominio de eosinófilos estuvo presente en ambas muestras, mientras que en 3 solamente existió predominio de eosinófilos en la primera toracocentesis (fig. 2). De los 6 pacientes que presentaban un DPE en ambas toracocentesis, el porcentaje de eosinófilos solamente fue mayor, en la segunda toracocentesis, en 1 caso. Entre los 91 pacientes que tenían un DPNE en la primera toracocentesis, 8 presentaron un DPE en alguna de las toracocentesis sucesivas (8,8%). El porcentaje de eosinófilos no aumentó en las toracocentesis sucesivas, ya que no hubo diferencias significativas entre las medianas de ambas muestras (p=0,427).
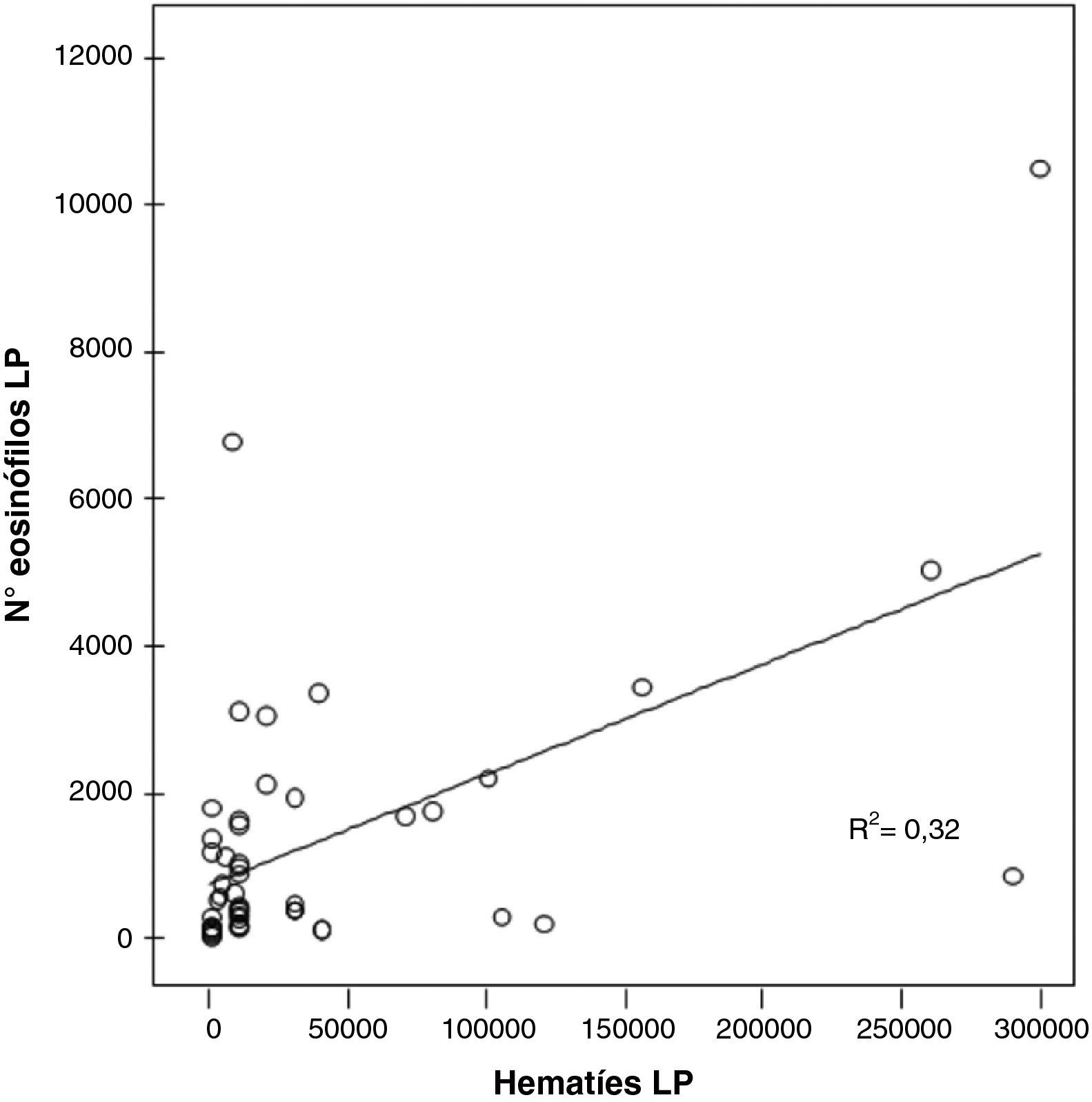
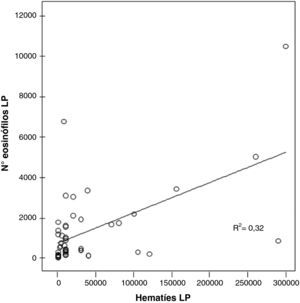
Se encontró correlación significativa, en el LP, entre el n.° de hematíes y el número de eosinófilos en los DPE (r=0,563; p<0,000) (fig. 3).
DiscusiónEste estudio confirma que la incidencia de derrames malignos en los DPE es similar a la que se encuentra en los DPNE y, por tanto, no se puede considerar el predominio de eosinófilos (≥ 10%) como un indicador de benignidad. Además, el porcentaje de eosinófilos no parece que aumente en toracocentesis sucesivas y, por último, la presencia de sangre en el LP podría justificar la aparición de un DPE.
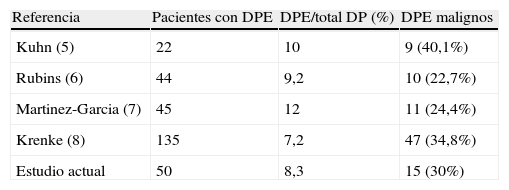
Desde la clásica revisión de Adelman et al3, en la que solamente encuentran un 8% de derrames malignos entre los 343 pacientes con un DPE, se considera que, ante un derrame pleural de estas características, la posibilidad de un derrame de etiología maligna es poco probable. Estos resultados fueron respaldados posteriormente, por Wysenbeek et al4 y Kamel et al12. Sin embargo, nuevos estudios no han confirmado este hallazgo5–8 (tabla 4) ya que, en todos ellos, la probabilidad de que un DPE sea de origen neoplásico fue similar a la de los DPNE. En esta línea, en nuestro estudio, el 30% de los DPE eran de origen neoplásico, por el 25,9% de los DPNE (diferencias no significativas).
Porcentaje de derrames malignos en los pacientes con derrames pleurales eosinofílicos
| Referencia | Pacientes con DPE | DPE/total DP (%) | DPE malignos |
| Kuhn (5) | 22 | 10 | 9 (40,1%) |
| Rubins (6) | 44 | 9,2 | 10 (22,7%) |
| Martinez-Garcia (7) | 45 | 12 | 11 (24,4%) |
| Krenke (8) | 135 | 7,2 | 47 (34,8%) |
| Estudio actual | 50 | 8,3 | 15 (30%) |
DP: derrame pleural; DPE: derrame pleural eosinofílico.
El alto cociente hombres/mujeres que hemos hallado con DPE (3,5/1) ya fue observado en estudios previos4,8,12. Además, el porcentaje de varones con DPE fue significativamente más elevado que en los DPNE (p=0,018). Asimismo, los DPE presentaron valores más elevados para los parámetros proteínas LP/P, LDH LP, LDH LP/P, colesterol LP y células nucleadas (tabla 1). Ya que estos resultados pueden estar influidos por el mayor número de trasudados del grupo de DPNE, se hizo un nuevo cálculo excluyendo los trasudados de ambos grupos. Se siguieron encontrando valores más elevados para las proteínas LP/P, LDH LP/P, colesterol LP y porcentaje y recuento de eosinófilos, éste último tanto en líquido pleural como en sangre (tabla 1). Estos resultados no se han podido comparar con los de otros autores porque no hay datos al respecto pero es posible que su aumento pueda responder a algún mecanismo patogénico implicado en la aparición de un DPE, desconocido hasta el momento2. Como era de esperar, el porcentaje y el recuento de eosinófilos en LP fue significativamente más elevado en los DPE. En los DPNE, tanto la mediana como los percentiles 25 – 75 del porcentaje de eosinófilos en LP fue cero, lo que significa que al menos en el 75% de estos derrames no se observaron eosinófilos en el LP. Treinta y uno de los 50 pacientes con un DPE tenían eosinofilia periférica pero no parece que este hecho guarde relación con la etiología del derrame ya que el origen de los mismos fue similar.
En el 36% de los DPE no se llegó a un diagnóstico definitivo, un porcentaje muy superior al 8,6% de los DPNE (p=0,000). Este dato es similar al publicado por Rubins y Rubins6, Martínez-García7 et al, aunque en este último caso sin diferencia significativa con respecto a los DPNE, y Adelman et al que hallan que los DPE se asocian a menudo con derrames idiopáticos3. El pronóstico de estos derrames parece ser favorable ya que en 15 de los 16 pacientes seguidos en nuestra consulta externa, el derrame se resolvió de forma espontánea en un plazo máximo de 6 meses. En los dos pacientes fallecidos, el derrame pleural ya había desaparecido y las causas de las muertes fueron procesos intercurrentes (infecciones respiratorias) con importante patología de base (EPOC grado 4 de la GOLD y neumoconiosis, respectivamente). El otro caso sigue controlado en nuestra consulta externa por persistencia del derrame sin que hasta la fecha se haya identificado la causa del mismo. En este sentido, aunque en un estudio diferente al nuestro, Rubins y Rubins refieren que los DPE, en general (no los de causa idiopática), tienen una supervivencia significativamente mayor (16,8 meses) que los DPNE (7,7 meses), independientemente de la edad6.
A pesar de que, como en otras series, el porcentaje de derrames malignos con un DPE se mueve en un rango relativamente bajo, entre el 5 y el 11%3,5–7 (9,4% en nuestro caso), las pleuritis neoplásicas fueron la segunda causa más frecuente de DPE (15/50; 30%) y la primera en los DPNE (144/555; 25,9%) sin que se encontraran diferencias significativas entre ambas. Kalomenidis y Light2, para explicar el aumento de eosinófilos en algunos derrames pleurales malignos, sugieren la posibilidad de que algunas células cancerígenas puedan producir quimiocinas y moléculas de adhesión, lo que podría atraer a los eosinófilos13. Es llamativo el hecho de que, en nuestra serie, el recuento de eosinófilos en los DPE no malignos es significativamente más elevado que en los malignos (p=0,041) (tabla 3). Este resultado concuerda con el de Krenke et al que encuentran una relación inversa entre el porcentaje de eosinófilos en LP y la proporción de pacientes con derrame pleural maligno8. Sin embargo, este parámetro tiene una capacidad muy discreta para discriminar, en el grupo de DPE, entre derrames malignos y no malignos (sensibilidad 60%, especificidad 63% para un punto de corte de 25% de eosinófilos).
De los 125 pacientes encuadrados en el grupo «otras etiologías» (tabla 2), llamado así para englobar todas aquellas enfermedades que no presentaban ningún DPE, 88 (70,4%) eran de origen tuberculoso. El hecho de que ninguna de estas pleuritis tenga un DPE es sorprendente ya que, aunque en otras series el porcentaje de tuberculosis es pequeño5,6,8, hay que tener en cuenta que, en todas ellas, la incidencia de derrames tuberculosos en el total de derrames es muy baja (menor del 3%), mientras que en la nuestra es del 14,5%. Por el contrario, en la serie de Martínez-García et al, en un medio similar al nuestro, con una incidencia de tuberculosis del 20,1%, el 9,7% de los derrames tuberculosos tienen un DPE y, el 15,6% de estos son tuberculosos7. En el caso de Kamel et al, en un estudio llevado a cabo en Túnez, un país con una alta prevalencia de pleuritis tuberculosa, el 39,6% de los DPE eran de origen tuberculoso12. De la misma forma, tampoco hemos encontrado ningún caso de embolia pulmonar (EP) con un DPE en los 6 pacientes de nuestra serie. Romero et al hallan que el 18% de sus 60 pacientes con un derrame pleural debido a una EP presentan un DPE14. Sin embargo, existe mucha discrepancia en este aspecto ya que los resultados de otros autores varían entre el 0%6 (como en nuestro estudio) y el 33%5, si bien el número de EP con derrame pleural de esta serie es pequeño (9 casos). La posibilidad de que un DPE secundario a una EP hubiera sido erróneamente clasificado como de origen no filiado nos parece muy poco probable ya que, como se recomienda, a todos los pacientes con un derrame pleural de causa desconocida, y clínica compatible, se les practicó una angio-tomografía computarizada (TC) de tórax15.
Tras el estudio de Adelman et al3 se afirmaba que la presencia de un DPE tras una toracocentesis previa podría ser debido a la entrada de aire o sangre en la cavidad pleural. En este sentido, Chung et al, en un estudio llevado a cabo en 26 pacientes con derrame pleural de origen neoplásico, concluyen que toracocentesis repetidas pueden inducir una liberación local de citoquinas proinflamatorias que explicaría el aumento de eosinófilos en estos casos16. Sin embargo, al igual que otros autores6,8,17, no hemos podido confirmar que la repetición de toracocentesis puedan ser la causa de un DPE. De los 9 pacientes que presentaron un DPE en la primera toracocentesis, 3 no lo mantuvieron en las toracocentesis sucesivas. De los 91 pacientes con un DPNE, el 8,8% presentaron un DPE en posteriores toracocentesis, similar al 8,3% de la toracocentesis inicial. Además, no hubo diferencias significativas entre el porcentaje de eosinófilos de la primera toracocentesis y de las sucesivas. Si bien varios estudios han demostrado que la inyección de sangre o aire puede causar eosinofilia peritoneal y pleural18,19, presumiblemente por un efecto quimiotáctico eosinófilo por parte de los hematíes o de las partículas de polvo suspendidas en el aire20, Kalomenidis y Light sostienen que, aunque es habitual que los pacientes con un traumatismo o una cirugía de tórax presenten un DPE, no es posible atribuir, por separado, a la entrada de aire y sangre en el espacio pleural el desarrollo de estos derrames. En su opinión, el denominador común de la presencia de aire o sangre en la cavidad pleural sería la lesión mecánica de la pleura. Esto originaría una deformación de las células mesoteliales que estimularía la liberación de quimiocinas responsables de la acumulación de eosinófilos2.
Se ha encontrado una correlación significativa entre el número de eosinófilos y de hematíes en el LP de los pacientes con un DPE (r=0,563; p<0,000) (fig. 3) lo que sugeriría que la presencia de sangre en el LP podría justificar la presencia de un DPE. Sin embargo, Rubin y Rubin no encontraron esta correlación6 por lo que serán necesarios nuevos estudios para confirmar este resultado.
En conclusión, nuestro estudio confirma que la presencia de un DPE no puede considerarse un indicador de benignidad por lo que, ante la presencia de un derrame pleural de estas características, el protocolo de estudio debería ser el habitual de cualquier derrame pleural. La repetición de toracocentesis no parece que aumente el número de eosinófilos. Por el contrario, la presencia de sangre en el LP podría justificar la existencia de un DPE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.