Clasificación de la enfermedad pulmonar obstructiva crónica (EPOC)
El interés por clasificar de alguna manera la gravedad de la enfermedad en los pacientes con EPOC es relativamente nuevo. Las primeras versiones de la normativa sobre la EPOC de la American Thoracic Society y de de la Sociedad Española de Neumología y Cirugía Torácica no recogían ninguna clasificación de la gravedad de la enfermedad1,2. Con el tiempo se ha visto la necesidad de estandarizar y clasificar de alguna manera a los pacientes con EPOC, que por otra parte presentan manifestaciones clínicas y exámenes complementarios relativamente heterogéneos. Disponer de una clasificación mediante un determinado parámetro tiene muchas ventajas: permite "hablar el mismo idioma en todo el mundo" para referirse a cuán grave está un paciente, sirve como instrumento epidemiológico y clínico, ayuda a planear recursos sanitarios, a pronosticar el curso de la enfermedad y, finalmente, a establecer una estrategia terapéutica basada en la gravedad de la enfermedad.
Un sistema de estadificación ideal para el caso de la EPOC debería informar al médico de la gravedad de las alteraciones de la función pulmonar como principal órgano afectado, de la percepción que el paciente tiene de la gravedad de estas lesiones y finalmente de su importancia para el conjunto de la salud del paciente. Estos factores o dominios (respiración, percepción, sistémico) están interrelacionados, pero no necesariamente tienen un grado de afectación paralelo. En el momento de publicarse la mayoría de las guías de manejo de la EPOC no se disponía de instrumentos validados que informaran sobre estas interrelaciones. El volumen espiratorio forzado en el primer segundo (FEV1) obtenido en la espirometría era el mejor parámetro con el que se relacionaba la mortalidad del paciente con EPOC y, en consecuencia, todas las sociedades científicas clasificaron la gravedad en función de su deterioro3-6.
El Dios FEV1
La EPOC se define como una entidad clínica que se caracteriza por la limitación al flujo aéreo. El valor del FEV1 en porcentaje del valor predicho refleja el grado de esta limitación, y consideramos que la irreversibilidad y cronicidad de este FEV1 reducido son características definitorias y diferenciadoras de la EPOC respecto a otras enfermedades obstructivas (p. ej., el asma). Estamos cómodos midiendo el FEV1 porque, tras décadas de trabajos de estandarización, es un valor muy sencillo y barato de obtener. El fundamento para su uso como expresión de la gravedad de la enfermedad es más cuestionable. Actualmente sigue siendo el parámetro funcional que mejor se relaciona con la mortalidad de la EPOC7,8. Sin embargo, sólo cuando el FEV1 se reduce por debajo del 50%, la relación entre el FEV1 y la mortalidad empieza a ser estadísticamente significativa. Anthonisen8 estudió la supervivencia a los 3 años en pacientes con EPOC incluidos en 2 ensayos clínicos norteamericanos, con valores similares de FEV1, en los que se evaluó la eficacia de la oxigenoterapia (estudio NOTT) y de sistemas de apoyo ventilatorio con presión positiva a domicilio (estudio IPPB)8. Dos hallazgos merecen resaltarse: a) la supervivencia de los pacientes sin hipoxia en el estudio IPPB fue similar a la de los pacientes hipóxicos que recibían oxígeno en el ensayo NOTT, y b) la supervivencia fue menor en pacientes que recibían menos horas de oxígeno. Es decir, con la aplicación de un tratamiento eficaz a pacientes con EPOC, otros factores diferentes del FEV1 pueden modificar la supervivencia. En la última década se ha mejorado enormemente el tratamiento de las exacerbaciones de la enfermedad, especialmente con la incorporación de la ventilación no invasiva, se han puesto en marcha programas de rehabilitación respiratoria eficaces, se están aplicando nuevos fármacos y se han desarrollado procedimientos quirúrgicos para el tratamiento del enfisema. El impacto sobre la mortalidad de estos procedimientos todavía no se ha establecido de forma adecuada. Por tanto, es posible que los pacientes actuales con un determinado FEV1 no puedan compararse con los controles históricos en términos de supervivencia. Finalmente, la muerte no el único elemento a valorar como efecto de una enfermedad crónica progresiva. La capacidad de realizar actividades de la vida diaria, la calidad de vida relacionada con la salud y la utilización de recursos sanitarios son actualmente elementos que deben evaluarse en el impacto de cualquier enfermedad crónica. En el caso de la EPOC, la relación del FEV1 con estos elementos es débil o simplemente no se ha estudiado9,10.
Clasificación GOLD
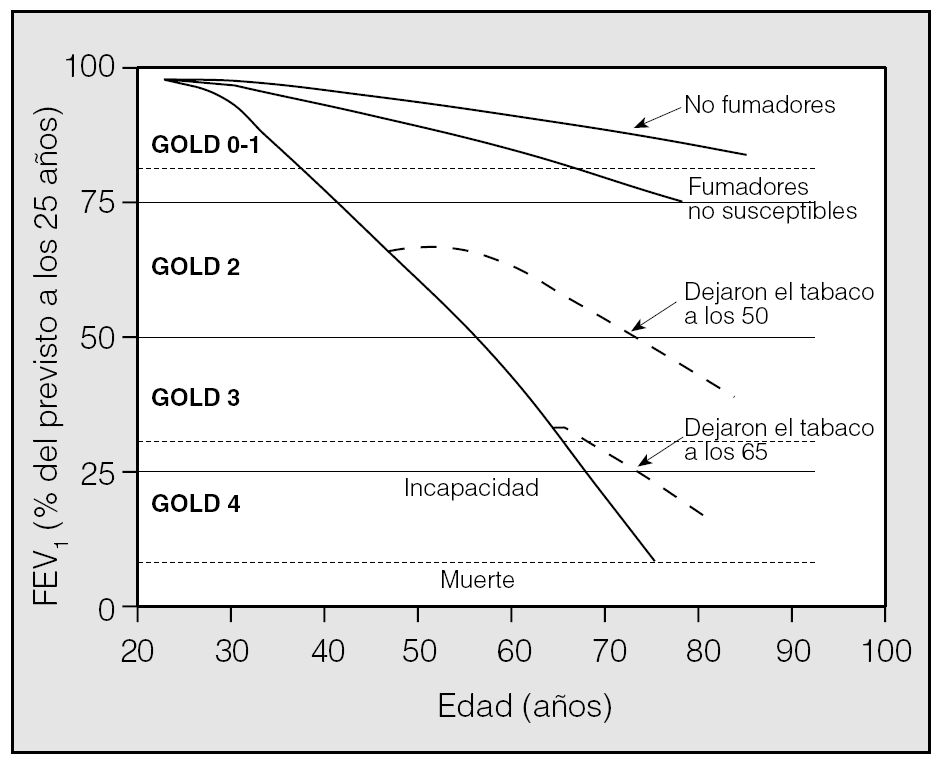
La Global Initiative for Chronic Obstructive Disease (GOLD) se realizó con los auspicios del Instituto para la Salud nortemericano como una respuesta "mundial" al incremento imparable de la EPOC como problema de salud pública en todo el mundo. La definición de la EPOC en GOLD reconoce el carácter progresivo de la enfermedad y el papel fundamental de la inflamación en su patogenia11. La clasificación de la gravedad de la enfermedad se realiza en 5 estadios (tabla I). Se incluye un estadio 0 para los pacientes que presentan tos, flemas o disnea pero sin que exista obstrucción al flujo aéreo. La idea era identificar tempranamente la enfermedad sin preconcebir esta fase como necesaria para la aparición de estadios posteriores. Los 4 estadios siguientes vienen definidos por la presencia de obstrucción (FEV1/capacidad vital forzada < 0,7) y 3 cortes de FEV1 en porcentaje del valor previsto: mayor del 80% (estadio I), entre el 80 y el 50% (estadio II), del 50 al 30% (estadio III) y menor del 30% (estadio IV). En la figura 1 se reproducen los clásicos datos de Fletcher y Peto12 que muestran las diferentes tasas de caídas del FEV1 con la edad en fumadores susceptibles y no susceptibles de presentar EPOC. Las líneas horizontales se han añadido para indicar la clasificación GOLD sobre estas tendencias. Muchos autores sostienen que los trabajos de Fletcher y Peto no son suficientes para basar la clasificación de la EPOC en sólo el FEV1, como ya hemos indicado. La crítica más importante sobre las clasificaciones basadas en el FEV1 es la pobre relación entre este parámetro y los síntomas del paciente13.
Fig. 1. Curvas de supervivencia en función de la declinación del volumen espiratorio forzado en el primer segundo (FEV1) con la edad y los estadios de gravedad de la EPOC de acuerdo con la Global Initiative for Chronic Obstructive Lung Disease (GOLD). (Adaptada de Pawels et al11 y Fletcher y Peto12.)
Clasificación de la Canadian Thoracic Society (CTS)
Criticando el modelo de clasificaciones sustentadas sólo en el FEV1, la CTS desarrolló un sistema basado en los síntomas y en la discapacidad de los pacientes como consecuencia de la enfermedad14. A este respecto, y basándose en la escala de disnea del Medical Research Council (MRC), clasifican la enfermedad en 4 estadios (tabla II). El grado 0 hace referencia a fumadores asintomáticos o a pacientes que presentan tos productiva sin disnea y en todo caso presentan una espirometría normal. A estos pacientes se les considera en riesgo de desarrollar una EPOC en el futuro y deben seguir visitas con espirometría. El tratamiento recomendado se gradúa en función de la disnea, de modo que en el estadio grave el tratamiento debe ser intenso y el paciente debe considerarse incapacitado para todo trabajo remunerado.
Pronóstico en la EPOC
El "pronóstico" de una enfermedad es un concepto que tradicionalmente hace referencia al tiempo que el sujeto tiene de vida desde que el médico le diagnostica la enfermedad. Al igual que en la mayoría de las enfermedades crónicas, en el caso de la EPOC los estudios epidemiológicos sobre el pronóstico se han centrado en la investigación del deterioro de la función del órgano y en la mortalidad asociada a esta enfermedad. Desde la última década del siglo pasado los efectos de la enfermedad, y por tanto del pronóstico, tienden a centrarse especialmente en el paciente15. En esta línea de pensamiento, además de la mortalidad como efecto principal de la enfermedad, se tienen en cuenta otras consecuencias como el deterioro en la calidad de vida, los síntomas, la capacidad de realizar actividades de la vida diaria, la utilización de recursos sanitarios y los costes económicos de la enfermedad para el paciente y la sociedad16. En el caso de la EPOC, en la tabla III se expone la relación entre los efectos de la enfermedad, sus consecuencias concretas y los instrumentos para medirlos. La importancia de cada parámetro de medida vendrá dada por su valor como predictor del tipo de efecto concreto de la enfermedad (p. ej., el FEV1 sobre la mortalidad). Valorar únicamente el potencial de mortalidad de una enfermedad crónica es infravalorar su impacto para el paciente y para la sociedad. Un estudio reciente sobre el impacto de la EPOC en los pacientes que la presentan en Gran Bretaña indicó que un 73% eran incapaces de desarrollar actividades que eran importantes para ellos, tales como tener relaciones sociales fuera de casa o realizar algún trabajo doméstico17. Estos pacientes tenían muy bajas expectativas respecto a la ayuda que podía prestarles el sistema sanitario y, en general, tendían a no seguir los consejos médicos. El pronóstico final de la EPOC puede verse así empeorado por elementos tales como la calidad de vida, no considerados habitualmente.
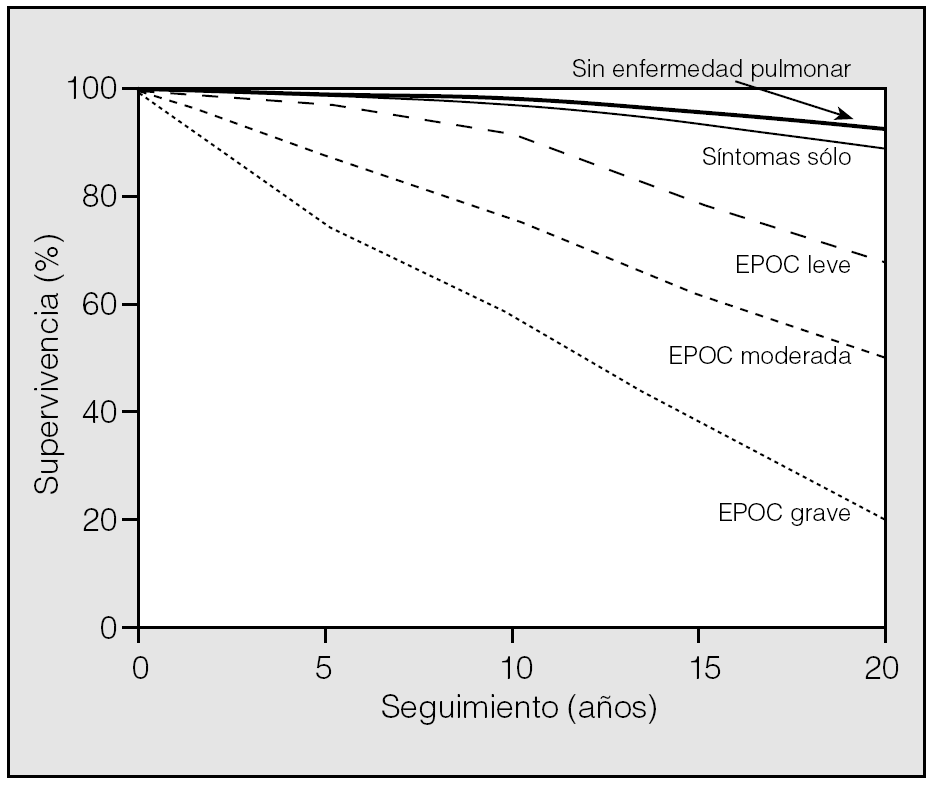
EL FEV1 sigue siendo el parámetro con mejor valor pronóstico en la EPOC. Recientemente se han revaluado los datos de supervivencia del estudio epidemiológico norteamericano sobre salud y nutrición (NHANES) que sigue a una cohorte de 5.542 sujetos seleccionados de la población general18. Tras 22 años de seguimiento, se volvió a demostrar que los sujetos que experimentaban EPOC presentan una supervivencia inversamente relacionada con el valor del FEV1 que tenían al entrar en el estudio (fig. 2). Un hallazgo interesante de este estudio fue que personas con un FEV1 por debajo del valor normal pero sin EPOC no mostraron una supervivencia acortada; esto concuerda con el hecho conocido de que un grado similar de obstrucción al flujo aéreo en el asma y en la EPOC es más letal en esta última que en la primera. Cuando se ha querido utilizar el FEV1 para evaluar la respuesta al tratamiento, este parámetro se ha demostrado insensible al efecto de tratamientos que, por otra parte, demostraron mejorar otras respuestas clínicas como la disnea, calidad de vida o utilización de recursos sanitarios19-21.
Fig. 2. Curvas de supervivencia de una cohorte de 5.542 sujetos estratificados según la presencia o ausencia de EPOC, presencia de síntomas respiratorios y gravedad de la EPOC cuando ésta estaba presente. EPOC leve: volumen espiratorio forzado en el primer segundo (FEV1) > 80% del predicho; EPOC moderada: FEV1 entre 50 y 80% del predicho; EPOC grave: FEV1 < 50% del predicho. (Modificada de Mannino et al18.)
La gasometría arterial se realiza de forma sistemática en la evaluación de pacientes con exacerbación de su enfermedad que acuden a urgencias. También debería realizarse en algún momento a pacientes con EPOC estable con un FEV1 inferior al 40% del valor previsto11. En estas circunstancias, la hipoxemia y la hipercapnia se consideran factores de riesgo de mortalidad y su tratamiento implica una mejoría en este exceso de mortalidad. La información que sustenta esta afirmación procede de estudios antiguos, llevados a cabo en una época con pocos recursos terapéuticos, y por tanto su valor clínico como instrumento predictor del pronóstico de la EPOC debería actualizarse.
La razón por la que ningún parámetro de función pulmonar se relaciona bien con los efectos sobre la morbimortalidad de la enfermedad es que en realidad la EPOC, sobre todo en fases avanzadas, se asocia a importantes consecuencias sistémicas, tales como inflamación, desnutrición y debilidad muscular. En la evaluación clínica de un paciente con EPOC no debe olvidarse esta premisa.
Disnea
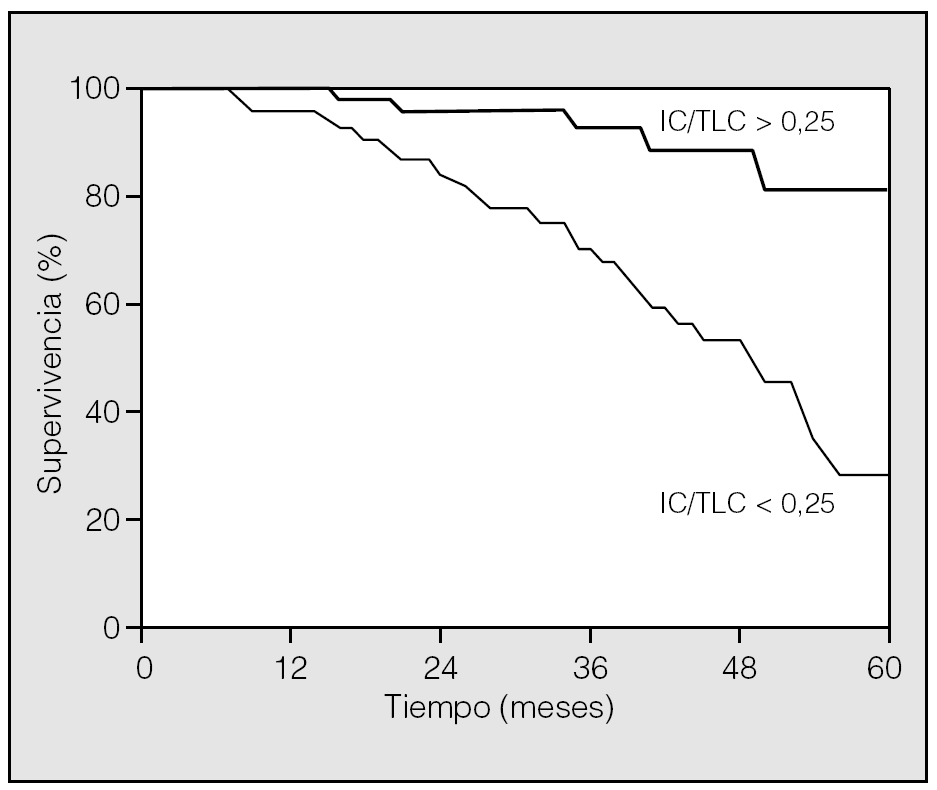
La GOLD indica claramente que la disnea es la consecuencia sintomática más evidente de la EPOC y recomienda su medición11. El grado de disnea cuantificado mediante escalas tipo MRC se relaciona bien con el estado de la calidad de vida del paciente, pero mal con su grado de obstrucción medido por el FEV122. De hecho, hoy conocemos que el factor fisiopatológico más importante que determina la disnea de esfuerzo en los pacientes con EPOC es el desarrollo de atrapamiento aéreo e hiperinsuflación dinámicos desencadenados por el ejercicio, incluido los esfuerzos asociados al desarrollo de las actividades de la vida diaria23,24. Es posible, por tanto, que los síntomas reflejen mejor que la simple medición del grado de obstrucción el deterioro funcional respiratorio del enfermo con EPOC. Esta hipótesis vendría apoyada por los hallazgos de varios grupos independientes que han demostrado cómo el grado de disnea, evaluado mediante cuestionarios sencillos, es un predictor independiente de mortalidad con un poder discriminativo superior al del propio FEV125-27. Nuestro grupo ha corroborado también la importancia pronóstica de la disnea28. Además, hemos encontrado una relación inversa entre el grado de hiperinsuflación y la supervivencia24. En nuestra serie se estudió de forma prospectiva a 689 pacientes con EPOC y se determinó el grado de hiperinsuflación basal mediante el cálculo del índice capacidad inspiratoria/capacidad pulmonar total. Tras 5 años de seguimiento, los pacientes en quienes dicho índice era inferior a 0,25 tenían una probabilidad 3,15 veces mayor de fallecimiento que aquéllos con un índice superior (intervalo de confianza del 95%, 2,15-4,63) (fig. 3). El análisis multivariante demostró que este índice se mantenía como un factor de riesgo independiente de otros como el FEV1, la edad, la disnea, la capacidad de ejercicio o la comorbilidad29. De la evidencia arriba descrita se puede concluir que el grado de disnea viene determinado por el nivel de hiperinsuflación pulmonar y que esta relación es tan estrecha que ambos parámetros por separado tienen valor predictivo de mortalidad en la EPOC.
Fig. 3. Curva de supervivencia de Kaplan-Meier de una cohorte de 689 pacientes con EPOC agrupados por el índice capacidad inspiratoria/capacidad pulmonar total (IC/TLC). El riesgo de muerte a los 5 años para los pacientes en quienes este índice era inferior a 0,25 fue 3,15 veces mayor respecto a los que tenían un índice superior a ese valor.
Capacidad de ejercicio
La limitación al ejercicio es la otra consecuencia principal de la progresión de la EPOC. La capacidad máxima de ejercicio, expresada como consumo máximo de oxígeno, se reduce paralelamente con el deterioro funcional, pero su correlación es pobre con el FEV130. El consumo máximo de oxígeno se obtiene durante pruebas de esfuerzo máximo, que precisan de aparatos relativamente complejos. La etiología de la limitación al ejercicio de los pacientes con EPOC es compleja, pero en general depende del compromiso ventilatorio de la enfermedad de base, que a su vez se relaciona con 3 factores que se dan en mayor o menor grado: a) flujo aéreo reducido que limita la capacidad de aumentar la ventilación pulmonar; b) hiperinsuflación dinámica que limita la capacidad de reclutar unidades pulmonares, sobrecarga la actividad de los músculos respiratorios y aumenta el trabajo de la respiración, y c) alteración del equilibrio ventilación-perfusión, propia de la presencia de enfisema pulmonar, y redistribución vascular. Al avanzar la enfermedad pulmonar se desarrolla compromiso ventricular derecho y el gasto cardíaco no aumenta de forma apropiada al trabajo ventilatorio, lo que contribuye de forma significativa a la limitación del esfuerzo. Pese a que consideramos que el consumo máximo de oxígeno constituye una variable que refleja la capacidad total del organismo para desarrollar ejercicio, su valor como predictor de mortalidad no se ha determinado.
Pruebas de ejercicio más sencillas, y que probablemente reflejan mejor el tipo de esfuerzo realizado durante las actividades de la vida diaria, como la prueba de marcha de 6 min, han demostrado ser buenos predictores de mortalidad en la EPOC, miocardiopatías e hipertensión pulmonar31-33.
Estado nutricional
Con el avance de la enfermedad, la EPOC alcanza una dimensión sistémica y se afectan otros órganos como la musculatura respiratoria y sistémica. Esto contribuye a reducir la actividad física general del paciente y a deteriorar su calidad de vida34. Muchos pacientes, probablemente como otro elemento del compromiso sistémico de su enfermedad, pierden peso de forma desproporcionada con la ingesta calórica, mientras que otros pacientes lo mantienen. De esta forma surgen fenotipos de pacientes diferentes: delgados y disneicos acianóticos (pink puffers) o congestivos cianóticos (blue bloaters). Varios estudios han demostrado la relación inversa entre el índice de masa corporal y la supervivencia en la EPOC, y lo más interesante es que esta relación no es lineal, sino que tiene un valor umbral de 21 kg/m2, por debajo del cual aumenta la mortalidad de forma desproporcionada35,36.
Evaluación multidimensional de la EPOC
Dada la presentación clínica y funcional tan variable de los pacientes con EPOC, así como su evolución imprevisible y la dificultad para evaluar la respuesta terapéutica mediante índices de función pulmonar, es razonable buscar un sistema de clasificación y evaluación de la gravedad de la enfermedad que contemple los diversos aspectos o dimensiones del efecto que para el paciente tiene la enfermedad (deterioro funcional, percepción o síntomas y afectación sistémica).
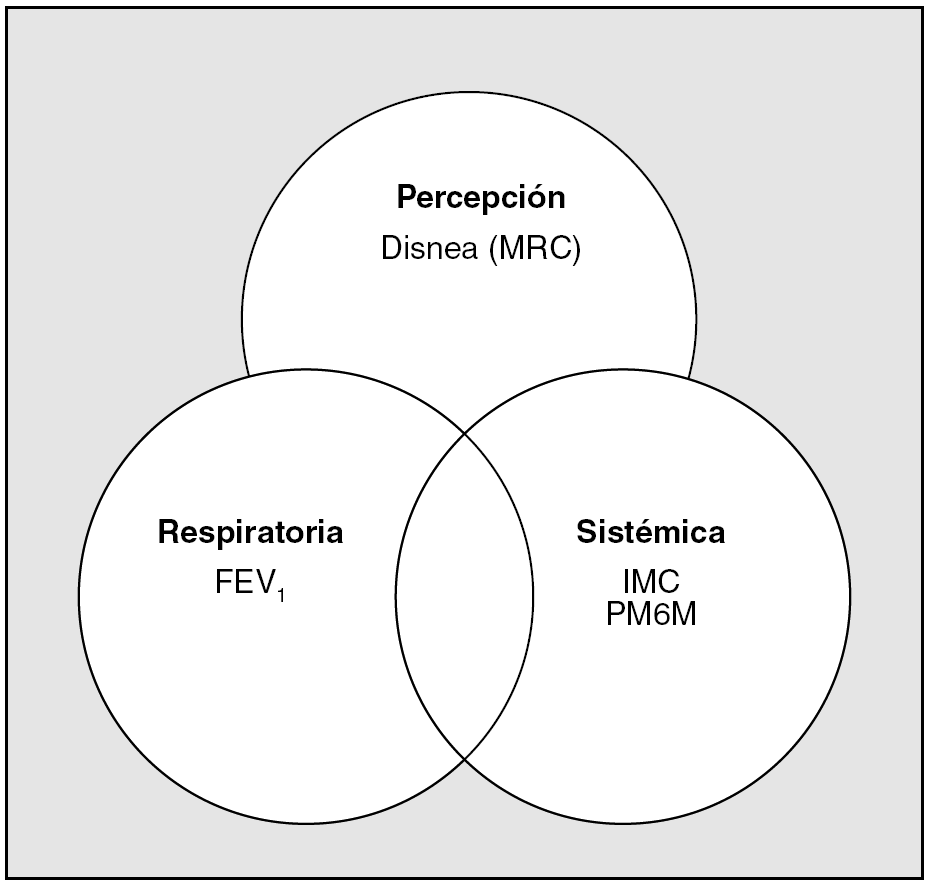
El Dr. Celli, que tiene el mérito de haber considerado la EPOC una entidad clínica con afectación multidimensional, lidera un grupo internacional de investigadores que valida actualmente una herramienta de medida (BODE) que incorpora la función pulmonar (FEV1), los síntomas (disnea), la capacidad de ejercicio (prueba de marcha) y el estado nutricional (índice de masa corporal)28. Con estos elementos, la idea que subyace es considerar la EPOC una entidad clínica en la que, a semejanza de las neoplasias sólidas, existirían 3 esferas de afectación: a) la extensión local del tumor (T), cuyo equivalente en la EPOC sería el deterioro funcional medido por el FEV1; b) la extensión regional (N), que se podría traducir en los afectados de EPOC como el grado de disnea, y c) la extensión extratorácica o sistémica (M), que podría asimilarse con el deterioro nutricional medido por el índice de masa corporal o la limitación al ejercicio medida por la prueba de marcha de 6 min. Estas relaciones podrían representarse en un diagrama de Venn, como el de la figura 4. Este sistema pretende acercarse más a la realidad del enfermo y puede servir como predictor del pronóstico de la enfermedad en un paciente concreto. Al tratarse de un instrumento multidimensional es posible que se detecten los cambios inducidos por la intervención terapéutica, a los que los actuales parámetros clínicos son insensibles.
Fig. 4. Modelo de evaluación multidimensional de la EPOC. En este diagrama de Venn, en el paciente con EPOC deben evaluarse 3 esferas de afectación: la alteración de la función pulmonar mediante el volumen espiratorio forzado en el primer segundo (FEV1); la intensidad de los síntomas clínicos que acarrean la enfermedad mediante la disnea, cuantificada en una escala como la del Medical Research Council (MRC), y las consecuencias sistémicas de la enfermedad, que se evaluarán registrando la talla y el peso del paciente para efectuar el cálculo del índice de masa corporal (IMC) y realizando una prueba de marcha de 6 min (PM6M).
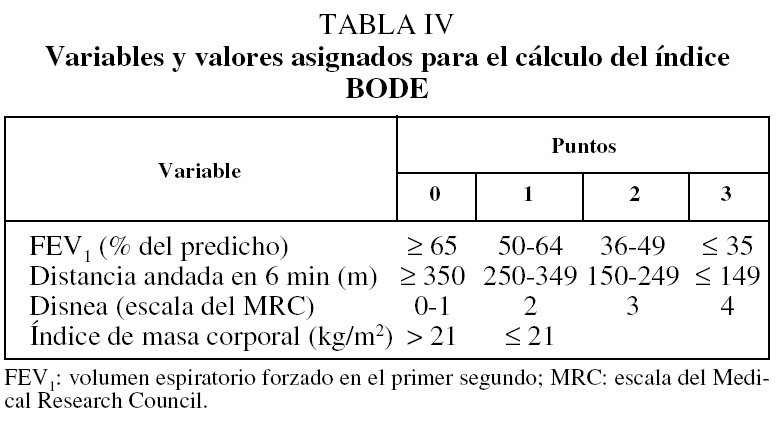
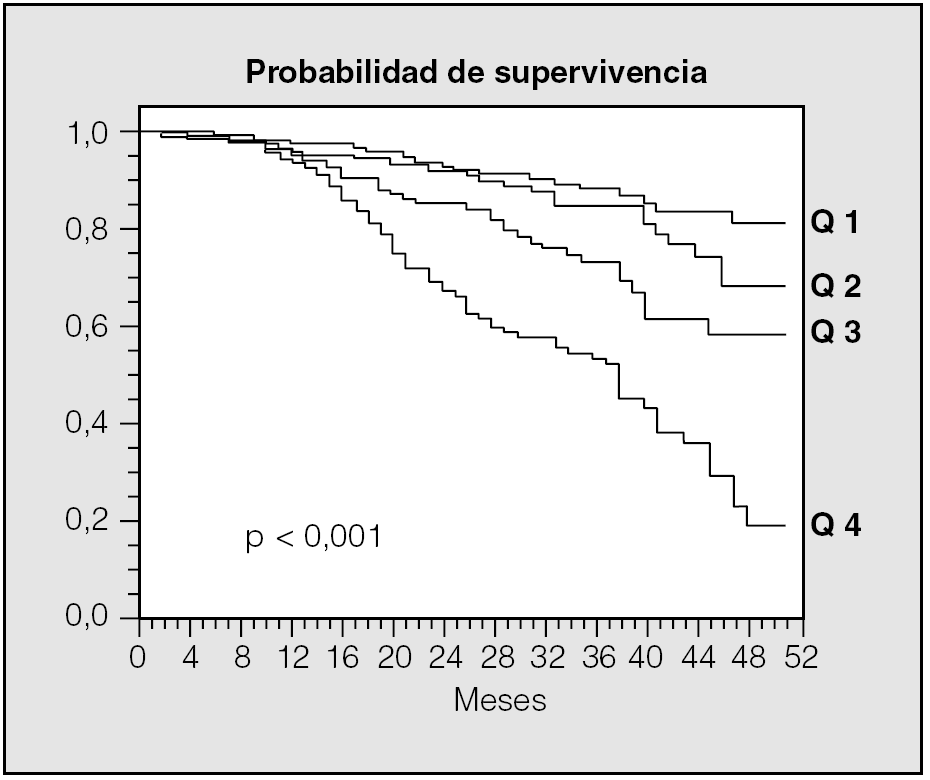
Recientemente se ha publicado la validación del modelo BODE como predictor de mortalidad en la EPOC. En este análisis se estudió a un total de 859 pacientes de forma prospectiva durante al menos un año en 3 países. Con los primeros 207 pacientes se pudieron establecer las variables que mejor se relacionaban con el riesgo de muerte al año. Éstas resultaron ser el FEV1, la distancia recorrida en la prueba de marcha de 6 min, la disnea evaluada mediante la escala del MRC y el índice de masa corporal. Cada una de estas variables se dividió en rangos a los que se les asignó un valor, tal como aparece en la tabla IV. A cada una de las 4 variables se le asigna una puntuación y se suman los puntos de forma que la puntuación final se encuentra entre el 0 y el 10. Cuado se analizó el conjunto de los 859 pacientes para evaluar la validez del modelo, resultó que el índice BODE fue un predictor de muerte por todas las causas y de muerte por causas respiratorias tras considerar otras posibles variables de confusión (tasas de riesgo de 1,32 y 1,62, respectivamente). Se construyeron curvas de supervivencia de Kaplan-Meier dividiendo a los pacientes en cuartiles según el valor del índice BODE (fig. 5). Los pacientes en el cuartil más alto (valor de BODE entre 7 y 10) presentaron una mortalidad del 80% a los 52 meses, mientras que los que se incluyeron en el cuartil 1 (índice de BODE entre 0 y 2) tuvieron una mortalidad a los 52 meses del 20%. El cálculo de la tasa de riesgo para cada punto del BODE indicó que cada punto de este índice aumenta la mortalidad total en 1,34 y la mortalidad por causas respiratorias en 1,62.
Fig. 5. Probabilidad de supervivencia de los pacientes con EPOC agrupados según el valor del índice BODE en 4 cuartiles.
Conclusiones
La GOLD recomienda que se evalúe a los pacientes para establecer la gravedad de su EPOC no sólo mediante la realización de una espirometría para obtener el FEV1, sino que debe registrarse el tipo de afectación clínica y graduar específicamente el grado de disnea. Estas 2 variables tienen un valor predictivo sobre el pronóstico de la enfermedad. Sin embargo, como se ha indicado a lo largo del texto, otros parámetros sencillos de obtener por cualquier médico, tales como el índice de masa corporal y la distancia recorrida en 6 min, también poseen un valor independiente predictor de muerte. La agrupación de estas 4 variables, que constituyen el índice BODE, tal como se ha explicado, muestra un excelente poder predictor no sólo de muerte, sino de utilización de recursos sanitarios, como ocurre en las exacerbaciones. El BODE es sencillo de calcular y no requiere utillaje complejo. Está por demostrar si este índice también será sensible a la intervención médica.