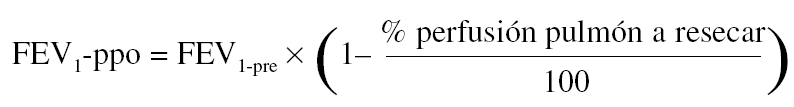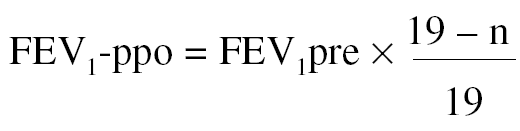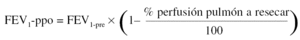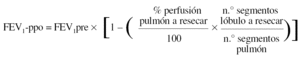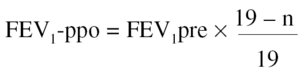Introducción
La resección pulmonar sigue siendo el tratamiento de elección en el carcinoma broncogénico (CB) localizado. Debido a que muchos de los pacientes que desarrollan un CB presentan una importante comorbilidad, la resección pulmonar se asocia con un riesgo no despreciable de complicaciones y muerte operatoria. Por lo tanto, es muy conveniente que exista un amplio consenso entre profesionales acerca de cuáles son las principales variables asociadas con el riesgo quirúrgico y cuál es el estudio preoperatorio recomendable en cada caso.
En esta normativa se han desarrollado algunos de los aspectos relacionados con la operabilidad1, u operabilidad funcional2 del paciente, definida como su capacidad para tolerar una cirugía de resección pulmonar sin que representen un elevado riesgo de muerte o de secuela invalidante. La resecabilidad1, u operabilidad oncológica3, es la capacidad, evaluada preoperatoriamente, para resecar completamente todo el tejido tumoral del CB con un pronóstico de beneficio, demostrado o presumible.
La metodología seguida para la redacción de esta normativa ha sido la de "consenso de expertos", puesto que la gran mayoría de las recomendaciones no pueden basarse en ensayos clínicos ni en otra metodología de investigación que permita un mayor grado de evidencia científica.
Riesgo quirúrgico en función del paciente
Aspectos generales
La edad se considera un predictor independiente de mortalidad tras la resección pulmonar4. En una serie de casos publicada en 1986 se detectó que el 26% de los pacientes con CB diagnosticados tenían 70 o más años5; además, en este grupo de mayor edad era más frecuente la inoperabilidad y el rechazo del paciente a la cirugía (el 5% en mayores de 70 años frente al 1,6% en menores de 70 años). En pacientes con 70 o más años la probabilidad de mortalidad para la neumonectomía (14%) duplica la existente para los menores de 60 años (6,5%)6.
En la actualidad, y con un bajo grado de evidencia, se considera indicado o desaconsejable la cirugía cuando se valoran una combinación de variables: edad, tipo de resección y estadio tumoral1,7. En pacientes con 70 o más años se considera la cirugía cuando el estadio tumoral clínico es IIc o inferior. Un factor desfavorable es la necesidad de neumonectomía, sobre todo si es derecha. Los pacientes con 80 o más años se consideran operables cuando el estadio es Ic y se indica lobectomía.
La presencia o ausencia de comorbilidad, el tamaño tumoral (en T2), la opinión del paciente, etc., son factores que deben tenerse en cuenta en la decisión final. Por ejemplo, un paciente de más de 70 años en estadio IIIAc por T3 (afectación de una costilla por invasión directa), N1M0 de 4 cm, sin comorbilidad y tratable con lobectomía, se puede considerar para la cirugía.
El estado clínico general (performance status en la bibliografía anglosajona) mide el grado de autonomía general del paciente. Se considera que un índice ECOG-WHO ≥ 2 ("necesidad de estar en casa durante el 50% o más del tiempo diario")7, que es equivalente al 50% del índice de Karnofski1, es un valor límite, si no recuperable, para la valoración de la operabilidad del paciente.
Comorbilidad
Frecuencia e impacto de la comorbilidad. Las enfermedades asociadas con CB pueden influir en las decisiones de la enfermedad tumoral en diferentes aspectos: en la predicción pronóstica8, en la contraindicación para el tratamiento quimiorradioterápico o en la valoración del riesgo de complicaciones o muerte en cirugía de resección pulmonar9.
En esta normativa, la comorbilidad en el CB se considera únicamente en su capacidad para influir en la operabilidad del paciente.
La frecuencia de comorbilidad significativa en CB (enfermedad pulmonar, cardíaca o diabetes) está directamente relacionada con la edad; entre 45 y 64 años, la comorbilidad se presenta en el 26,6% de los casos; entre 65 y 74 años, en el 39%, y entre 75 y 90 años, en el 46%10. A mayor edad, mayor probabilidad de comorbilidad.
Paralelamente, la edad media de los pacientes diagnosticados de CB en nuestro país se ha elevado en los últimos 25 años. En una serie multicéntrica de casos diagnosticados de CB, en la década de los setenta, la media de edad era de 60 ± 9,1211; en otro estudio cooperativo español que recoge casos quirúrgicos entre 1993 y 1997, la edad media era de 64 ± 1012.
Por todo ello, la comorbilidad, como posible factor determinante en la valoración de la operabilidad, va a seguir siendo importante, y de forma creciente, en las próximas décadas.
En un estudio de 3.516 pacientes con resección pulmonar dependientes de la Administración de Veteranos en Estados Unidos (88% resecciones por CB), el 39% tenía enfermedad pulmonar obstructiva crónica (EPOC); el 38%, hipertensión arterial, y el 11%, diabetes mellitus4. En España, en un estudio sobre incidencia de CB en la comunidad autónoma de Castilla y León durante 1997, la asociación de CB y EPOC se detectó en el 50% de los pacientes13. La patología cardíaca estaba presente en el 14% de los CB diagnosticados; la enfermedad vascular periférica, en el 9%; la hipertensión arterial, en el 11%, y la diabetes mellitus, en el 7%.
En otro estudio español con cerca de 3.000 casos de CB operados entre 1993 y 1997 en 19 hospitales, el 73% de los casos (n = 2.189) presentaban alguna o varias comorbilidades3. El 50% (n = 1.504) tenía asociada EPOC al CB y, de ellos, el 32% tenía un volumen espiratorio forzado en el primer segundo (FEV1) < 70%. También en este trabajo se observa una relación directa entre edad y probabilidad de comorbilidad.
Al considerar globalmente el problema de la comorbilidad en la valoración de la operabilidad, se considera inoperable al paciente con una "patología asociada grave e incontrolable como enfermedad mental o cualquier otra que limite seriamente, y de forma permanente o prolongada, las capacidades psicofísicas más básicas del paciente o cuyo pronóstico intrínseco sea fatal a corto plazo"1.
Comorbilidad sistémica. En una reciente revisión9 se considera que la hipertensión arterial, la hipoalbuminemia, la obesidad, la diabetes mellitus, la insuficiencia renal o la presencia de enfermedad neuromuscular o de enfermedad deformante de la pared torácica son predictivas de riesgo de complicaciones en cirugía pulmonar. Sin embargo, la enfermedad vascular periférica, la patología cerebrovascular o la presencia de soplo carotídeo no se consideran de riesgo. En una evaluación española de factores predictivos de morbimortalidad operatoria en CB se detectó que la enfermedad vascular periférica era, en análisis univariante y multivariante, un factor independiente para la morbilidad y para la mortalidad postoperatorias14.
En las recientes guías publicadas por la Sociedad Británica del Tórax7 se considera que en pacientes con antecedentes de accidente cerebrovascular o isquémico transitorio, o de soplo carotídeo, se precisa la evaluación con eco-Doppler, y si la obstrucción es > al 70% cabe considerar la cirugía vascular pretoracotomía.
La relación entre la variable peso y la operabilidad es múltiple. Un índice de masa corporal bajo parece comportarse como un factor de riesgo de complicaciones7; la obesidad se considera otro factor de riesgo para cualquier cirugía, y también para la torácica, por la mayor facilidad de atelectasias o de enfermedad isquémica cardíaca asociada (más frecuente en mujeres)15. Una pérdida de peso significativa no voluntaria (más del 10% del peso habitual) se considera también un factor de riesgo de complicaciones tras cirugía pulmonar16.
Diversas series han considerado la hipoalbuminemia como un consistente factor de riesgo de complicaciones4,7,16. La corrección, en lo posible, de estos parámetros relacionados con el peso y la nutrición puede hacer revertir el riesgo, y se preconiza la terapia nutricional durante los 7-10 días previos a la cirugía en casos de pérdida reciente de peso superior al 10% o presencia de albúmina sérica inferior a 2,5 g/dl16.
La hipertensión arterial significativa (diastólica > 110 mmHg)15 o la presencia de diabetes mellitus (mayor asociación con enfermedad isquémica cardíaca, frecuentemente silente)14,15 son otros factores de riesgo por patología sistémica.
Recientemente se ha observado que los valores de lactatodeshidrogenasa sérica pueden ser un factor predictivo independiente de complicaciones pulmonares tras una lobectomía por CB17.
Enfermedad cardíaca. Se presupone que, igual que con la EPOC, al compartir con el CB un mismo agente etiológico (tabaco), la cardiopatía isquémica puede ser frecuente en esta población. Además, la cirugía de resección pulmonar puede considerarse que representa un riesgo en estos pacientes al amputar lecho vascular pulmonar de forma significativa.
En un reciente trabajo español, la mortalidad operatoria en presencia de enfermedad cardíaca (la mayoría por enfermedad isquémica) es el doble que en su ausencia18, y esto es válido para neumonectomía (el 25 frente al 12%) y para el resto de resecciones pulmonares (el 7,6 frente al 4,6%).
En la valoración de estos pacientes, algunas guías defienden el electrocardiograma en todos los pacientes con CB en los que se prevé cirugía y un ecocardiograma si presentan soplo cardíaco7. En esta normativa no se va a profundizar en la evaluación cardiológica y se remite al lector a las publicaciones de la Sociedad Española de Cardiología y a las de las asociaciones profesionales cardiológicas estadounidenses19,20.
Patología pulmonar. Los pacientes con EPOC, con alveolitis fibrosante criptogenética y con silicosis tienen mayor riesgo de CB, independientemente del hábito tabáquico21-23. Paralelamente, la cirugía del CB, para ser oncológicamente válida, precisa en general de resección pulmonar de tejido no neoplásico. La conjunción de todos estos factores puede crear una situación de incertidumbre en la decisión clínica quirúrgica sobre la operabilidad del paciente.
En relación con la EPOC, la SEPAR ha publicado recientemente una normativa que incluye la actitud ante la cirugía, tanto para la realización de las medidas perioperatorias como en la descripción de un algoritmo para la toma de decisiones en pacientes con EPOC candidatos a la resección pulmonar24. También la Sociedad Británica del Tórax describe un algoritmo con los mismos propósitos7. En ambos se considera la EPOC como una enfermedad uniforme y el cálculo del FEV1 postoperatorio como un dato fundamental de evaluación. Sin embargo, se ha detectado que hasta en un 18% de CB operados con FEV1 real preoperatorio < 2,5 l, tras una resección pulmonar, el FEV1 postoperatorio no se ha modificado o se ha incrementado en relación con el preoperatorio25; en los casos que exista, este comportamiento, es significativamente más frecuente en la lobectomía y una función pulmonar más deteriorada. Este hecho, ya descrito previamente26, incrementa la incertidumbre en las decisiones. En esta misma normativa se detallan otras evaluaciones más precisas para mejorar la exactitud de nuestras predicciones de riesgo en presencia de comorbilidad pulmonar.
Métodos multiparamétricos. En un estudio sobre morbilidad postoperatoria tras cirugía de CB, el mejor modelo asociativo combinaba variables funcionales (difusión, FEV1 predicho), variables endoscópicas (segmentos obstruidos que se van a resecar), variables clínicas de comorbilidad (EPOC, hipertensión arterial sistémica) y una variable de estadificación TNM patológica (Np)27.
En otro trabajo reciente sobre morbilidad cardiorrespiratoria, las variables asociadas incluían, junto con variables funcionales y terapéuticas, la presencia de comorbilidad (enfermedad cardíaca isquémica, arritmias, diabetes) y la estadificación tumoral28.
Para la cirugía de resección pulmonar se han considerado índices multiparamétricos de riesgo con la valoración, entre otras, de las variables no funcionales cardiorrespiratorias. Uno de estos sistemas combina variables tales como el sexo, la historia tabáquica, la albúmina sérica, el recuento linfocitario y la presencia de diabetes para la predicción de la morbilidad postoperatoria29.
El índice de comorbilidad de Romano30 es una mezcla de enfermedades asociadas en la que cada una tiene su puntuación. Las patologías consideradas son: la enfermedad isquémica cardíaca, el fallo cardíaco congestivo, la enfermedad vascular periférica, la enfermedad cerebrovascular, la insuficiencia renal crónica, la diabetes mellitus, la enfermedad hepática grave, la presencia de EPOC y/o la de malignidad. Este índice se ha utilizado para la predicción de grupos de riesgo en resección pulmonar, combinados con otros factores31. El grupo de riesgo más importante, según esta experiencia, es el que combina la resección por CB con un FEV1 ≤ 80% y un índice de comorbilidad ≥ 4. Con esta combinación, la probabilidad de mortalidad operatoria es del 24%. Un índice de comorbilidad de 4 se alcanza con la presencia de EPOC y diabetes mellitus.
En otro trabajo se evalúa el riesgo de complicaciones cardíacas en pacientes estables con cirugía no cardíaca, mayor y no urgente32. Con un simple índice se podría predecir un amplio rango de probabilidad de complicaciones cardíacas: desde el 0,4 al 11%. Las variables consideradas son: tipo de cirugía, historial de enfermedad isquémica cardíaca, de fallo cardíaco congestivo o de enfermedad cerebrovascular. Como ya se ha comentado, este índice es útil por su simplicidad o sencillez, pero puede que no sea aplicable en todos los ámbitos quirúrgicos; estos índices son válidos como guías genéricas más que para un cálculo exacto del riesgo33. Cuando se han comparado diferentes índices de predicción del riesgo cardíaco (índice de la Sociedad Americana de Anestesia, índice de Goldman, etc.), se observa que todos tienen un área bajo la curva característica operacional (ROC) similar: alrededor de 0,6-0,734; con esos valores, parece que estos sistemas predicen el riesgo mejor que el azar, pero esto aún es muy insuficiente. Todavía existe una alta probabilidad de variabilidad no controlada con los índices propuestos.
Evaluación preoperatoria de la función pulmonar
Gasometría arterial
El valor predictivo de los valores de la gasometría arterial en la inoperabilidad de los pacientes para resección pulmonar es pequeño; con todo, es un análisis obligado y de rutina en la evaluación de este tipo de pacientes.
La presión arterial parcial de oxígeno en sangre (PaO2) < 50-60 mmHg se considera un factor de riesgo para la resección pulmonar y una contraindicación para la cirugía35-38. Sin embargo, antes de la exclusión de los pacientes se recomienda realizar una prueba de ejercicio y observar la respuesta de la PaO2 durante éste7. Si disminuye aún más su valor, se considera contraindicada la cirugía. Por el contrario, si se mantiene o aumenta, se considera operable aunque con alto riesgo quirúrgico.
La presión arterial parcial de anhídrido carbónico (PaCO2) nos indica la situación de la ventilación alveolar. Tienen alto riesgo quirúrgico los pacientes con valores elevados de la PaCO2 situados de forma persistente por encima de 45 mmHg, siempre que se excluya la enfermedad neuromuscular o la hipoventilación inducida por fármacos39,40. La hipercapnia mantenida implica, por tanto, un fallo respiratorio crónico y el aumento del riesgo quirúrgico, por lo que los pacientes deben ser excluidos de la cirugía. Sin embargo, hay autores que no han detectado un mayor riesgo de morbimortalidad40-42, por lo que, en sí mismo, no es un criterio de exclusión aunque sí decisivo junto con las otras pruebas de evaluación preoperatoria. Puede ser interesante realizar una prueba de esfuerzo y analizar si los pacientes son capaces de efectuarla adecuadamente7,43.
Espirometría
La función respiratoria alterada es un factor de riesgo de morbimortalidad postoperatoria así como de posible discapacidad a largo plazo y de mala calidad de vida secundaria a causa de una insuficiencia respiratoria. Este riesgo depende, por tanto, de la función pulmonar pre-operatoria y de la extensión de la cirugía que se va a realizar.
Así como el FEV1 es el principal factor pronóstico de la EPOC, también es el principal factor y más fiable en la identificación de pacientes con alto riesgo quirúrgico7.
Por este motivo, todos los pacientes que se van a someter a una resección pulmonar deben someterse a una espirometría que debe realizarse cuando el paciente se encuentre clínicamente estable y con el máximo tratamiento médico. De este modo, los valores que se tendrán en cuenta son los medidos tras la broncodilatación. Así, en pacientes con obstrucción del flujo respiratorio, la espirometría se puede repetir tras 1 o 2 semanas de tratamiento broncodilatador intensivo.
Las recomendaciones sobre los valores mínimos aceptables del FEV1 varían de unos trabajos a otros, pero en ninguno se establece un límite claro y definitivo41,44,45.
En algunas publicaciones recientes7 se considera que un FEV1 > 2 l para una neumonectomía y > 1,5 l para una lobectomía es indicativo de una mortalidad < 5%, por lo que son valores seguros para estos tipos de resección pulmonar, siempre y cuando el paciente no presente signos de una enfermedad pulmonar intersticial (en este caso se necesitan otras pruebas funcionales que evalúen mejor la capacidad respiratoria del paciente, como la difusión). Sin embargo, es más adecuado no utilizar los valores absolutos sino los porcentajes respecto al valor teórico. Algunos autores definen como límite de seguridad para la resección un FEV1 > 80% del valor teórico41,46. Por debajo de estos valores sería recomendable realizar otras pruebas de selección, pero no hay un grado suficiente de evidencia científica para recomendar un punto de corte concreto.
Para los autores que continúan utilizando valores absolutos, si el FEV1 se encuentra entre 0,8 y 2 l es necesario realizar más pruebas, como el cálculo del FEV1 postoperatorio u otras que se comentan posteriormente, antes de tomar decisiones. Si el FEV1 es < 800 ml se considera directamente excluido de la cirugía, puesto que dicho valor de FEV1 se asocia con una mayor facilidad para la hipercapnia, menor tolerancia al ejercicio y mayor mortalidad por insuficiencia respiratoria. Sin embargo, como ya se ha comentado, el valor absoluto del FEV1 no tiene idéntico sentido entre las diferentes personas debido a las variaciones en función de la edad, el sexo, la talla y la raza, motivo por el que se preconiza el uso del 30% del FEV1 teórico como indicativo de inoperabilidad, que sustituye al clásico valor de 800 ml.
Difusión
En muchos trabajos se ha demostrado que la medida de la capacidad de transferencia de monóxido de carbono (TLCO) es un buen indicador de la mortalidad y de las complicaciones pulmonares de la resección pulmonar47,48, pero hay otros estudios que demuestran claramente la relación entre una capacidad de difusión baja y la aparición de estas complicaciones. Por ello, la TLCO no es una prueba de rutina en la evaluación preoperatoria del cáncer de pulmón, aunque se aconseja su realización cuando exista la sospecha de una enfermedad pulmonar intersticial que puede no evaluarse con la espirometría7, en pacientes con disnea no justificable por sus volúmenes pulmonares y por disfunción cardíaca, y en pacientes que han recibido quimioterapia de inducción, como se verá más adelante.
Se considera que un valor de la TLCO < 60% es indicativo de inoperabilidad para la neumonectomía y cuando es < 50% para la lobectomía, lo que nos obligaría a realizar otras pruebas antes de rechazar al paciente para la cirugía.
Estimación de la función pulmonar posquirúrgica
Estudio de la función unilateral
Los estudios con isótopos radiactivos permiten analizar la distribución regional de la ventilación, con el empleo de 133Xe, o de la perfusión, con el empleo de macroagregados de albúmina marcados con 99Tc. El estudio gammagráfico de la distribución de la perfusión es el más empleado en la actualidad para la estimación de la función pulmonar quirúrgica, dado que es de ejecución sencilla y bastante accesible.
Cálculo de la función pulmonar posquirúrgica.
1. Con mediciones de función unilateral. Se realiza mediante ecuaciones sencillas a partir de la información proporcionada por alguna de las técnicas de medición de función unilateral, habitualmente la gammagrafía pulmonar de perfusión cuantificada. La cuantificación de la distribución de la perfusión se realiza mediante el recuento de la señal emitida por el isótopo radiactivo en cada uno de los hemitórax, cuyo valor se divide por la suma de los recuentos en ambos hemitórax.
Habitualmente, los recuentos se analizan en el plano posterior37, aunque algunos autores promedian los resultados obtenidos en los planos anterior y posterior49.
Para la estimación del volumen espiratorio forzado en el primer segundo predicho postoperatorio (FEV1-ppo) las fórmulas empleadas comúnmente son, en el caso de neumonectomía:
Y en el caso de lobectomía:
Donde FEV1pre = FEV1 preoperatorio (habitualmente, el valor obtenido tras administrar un broncodilatador).
Numerosos estudios han demostrado una buena concordancia entre el valor de FEV1-ppo, calculado a partir de los resultados de la gammagrafía pulmonar de perfusión cuantificada, y el valor medido tras la intervención41. De todos modos, existen ciertas limitaciones en la predicción cuando la proporción de perfusión en el pulmón neoplásico es baja, ya que tiende a sobreestimarse el valor postoperatorio previsto50. Además, la correlación entre el tipo de cirugía programado y el realizado no es perfecta, lo que aumenta el grado de inexactitud en el cálculo del FEV1-ppo51.
De forma análoga al FEV1-ppo, se puede estimar el valor postoperatorio de la capacidad de difusión de CO (TLCO-ppo)49,52 y del consumo de oxígeno en el esfuerzo "pico" (VO2pico-ppo)52-54.
2. A partir del número de segmentos resecados. Algunos autores se han servido de una alternativa sencilla para el cálculo de la función pulmonar posquirúrgica, sin realizar estudios de función unilateral, basándose sólo en el número de segmentos extirpados en la cirugía55. Para el cálculo del FEV1-ppo se emplea la siguiente fórmula:
Donde n = número de segmentos a resecar, y 19 es el número total de segmentos en ambos pulmones.
Con el empleo de este método de estimación se han obtenido buenas correlaciones con el valor medido tras la intervención, cuando el valor de FEV1 preoperatorio era > al 55% del de referencia55. Esta fórmula también se ha aplicado al cálculo de la TLCO-ppo, se ha observado una buena correlación con el valor medido tras la intervención55.
Expresión de los resultados. Los resultados del FEV1-ppo pueden expresarse en unidades de volumen (litros o mililitros) aunque, como se ha comentado antes, dicho valor en términos absolutos tiene poco sentido porque el valor de FEV1 depende del sexo, la edad y la talla del individuo. Por este motivo es preferible expresar siempre el FEV1-ppo como porcentaje del valor de referencia.
La TLCO-ppo suele expresarse como porcentaje del valor de referencia.
El VO2pico-ppo se ha expresado en ml/min/kg56, aunque por las mismas razones aducidas anteriormente es más conveniente expresarlo como porcentaje del valor de referencia.
Parámetros multifactoriales. Recientemente se ha desarrollado el concepto de producto postoperatorio estimado (predicted postoperative product, [PPP])55, variable que resulta de multiplicar el FEV1-ppo por la TLCO-ppo, expresados ambos como porcentaje del valor de referencia.
Implicaciones clínicas. Múltiples estudios han demostrado que los parámetros obtenidos en la estimación de la función pulmonar posquirúrgica son buenos predictores de la posibilidad de que se presenten complicaciones en el período postoperatorio. El parámetro más analizado ha sido el FEV1-ppo, del que se ha demostrado su valor predictivo de complicaciones postoperatorias tanto en poblaciones no seleccionadas41 como en poblaciones seleccionadas por su mayor riesgo57. Valores bajos de TLCO-ppo49 y de VO2pico-ppo56 también se han asociado con un mayor riesgo de presentar complicaciones en el período postoperatorio.
Un valor bajo del producto postoperatorio estimado (< 1.650) se ha asociado con un mayor riesgo de mortalidad en el período postoperatorio55,57. A pesar de los numerosos estudios efectuados en este campo, no ha sido posible establecer valores "límite" suficientemente contrastados en los parámetros derivados de la estima pulmonar posquirúrgica que permitan establecer con precisión la contraindicación de la cirugía.
Pruebas de esfuerzo
El mecanismo fisiopatológico por el que las mediciones obtenidas en el ejercicio se relacionarían con las complicaciones no está claro. En teoría, al aumentar las demandas funcionales de los sistemas respiratorio, circulatorio y de transporte de oxígeno se pondrían de manifiesto disfunciones no apreciables en las pruebas en reposo y, en el caso de la cirugía de tórax, si existe suficiente reserva funcional para tolerar la intervención.
Los estudios que han analizado el valor de las pruebas de esfuerzo en la predicción del riesgo quirúrgico se pueden agrupar en 2 categorías: estudios que analizan la tolerancia al ejercicio, es decir, la facultad para hacer cierta tarea, como subir escaleras, y estudios que analizan la capacidad de predicción de ciertas variables obtenidas durante la prueba de esfuerzo.
Estudios de tolerancia al esfuerzo
Varios estudios han analizado el valor predictivo de la realización de una tarea específica como andar una distancia determinada en un tiempo58,59 o subir cierto número de escalones60. Se puede concluir que los pacientes capaces de consumar dichas tareas, que en la mayoría de los casos requerían esfuerzos vigorosos, tuvieron un riesgo perioperatorio bajo. Los resultados publicados no permiten establecer una relación precisa entre tolerancia y riesgo o un criterio de tolerancia asociado con un riesgo inaceptable de mortalidad. Los estudios que han comparado la capacidad para predecir la morbilidad post-operatoria de las pruebas de tolerancia con las pruebas de función basal ofrecen resultados contradictorios. Ninguno analizó una muestra suficiente que permita concluir la superioridad o inferioridad de las pruebas de tolerancia con respecto a las pruebas de función basal para predecir la mortalidad perioperatoria.
Consumo máximo de oxígeno
La relación entre el consumo de oxígeno en esfuerzo máximo (V.O2máx) y el riesgo perioperatorio ha sido el objeto de múltiples estudios desde los años ochenta. Por necesidades de espacio se citan sólo algunos artículos que consideramos más relevantes. Se ha propuesto46 el uso del consumo máximo de oxígeno como segundo escalón en la valoración del riesgo operatorio --es decir, antes de realizar una gammagrafía cuantitativa para estimar la función postoperatoria--. A la luz de la información disponible, ésta es una alternativa razonable si se dispone del equipo necesario. En varios estudios56,61 se ha correlacionado el VO'2máx con la mortalidad de la resección. Bolliger et al56 publicaron que ninguno de los no fallecidos en su serie tenían un consumo de oxígeno en esfuerzo máximo, predicho postoperatorio (V.O2máx-ppo) < 10 ml/min/kg, mientras que en el artículo de Larson et al61 un V.O2máx < 50% separaba a los pacientes que murieron por causas cardiopulmonares de los que no. También se ha correlacionado un V.O2máx62,63 con la morbilidad cardiorrespiratoria postoperatoria con un punto de corte de 20 ml/min/kg para el V.O2máx y de 15 ml/min/kg para la captación de oxígeno en el umbral de acidosis láctica (V.O2LT).
Puente et al64, al estudiar a pacientes con limitación crónica al flujo respiratorio y FEV1 < 2 l y > 0,8 l, encontraron una relación entre el tamaño de la resección, la relación entre el volumen residual y la capacidad pulmonar total (RV/TLC), la TLCO-ppo (pero no el FEV1-ppo), el V.O2máx y el VO'2máx-ppo y las complicaciones cardiorrespiratorias. Tanto el V.O2máx como el VO'2máx-ppo tenían una correlación significativamente mayor que los parámetros de función basal. Los mejores puntos de corte fueron 13 ml/min/kg para la V.O2máx-ppo y 17 ml/min/kg para la V.O2máx. Estos puntos de corte tenían un alto valor predictivo negativo (90%), pero el valor predictivo positivo era bajo (75 y 60%, respectivamente). Los modelos multivariables no mejoraron la capacidad de predicción. Por el contrario, otros autores65 no encontraron relación entre las complicaciones postoperatorias y la capacidad de esfuerzo preoperatoria, aunque incluyeron en las complicaciones problemas técnicos como fugas aéreas persistentes, pérdidas excesivas de sangre, infecciones de la herida y empiemas. Boysen et al66 estudiaron 17 pacientes con muy buena función. No encontraron relación entre el V.O2máx, la ventilación máxima en la prueba de esfuerzo limitada por síntomas (V.Emáx) o el pulso máximo de oxígeno (PuO2máx) obtenidos en una prueba máxima en tapiz rodante y la incidencia de complicaciones cardiopulmonares postoperatorias. La relación entre V.Emáx o la frecuencia cardíaca máxima y sus valores teóricos se relacionó con la ocurrencia total de complicaciones pero no específicamente con las complicaciones cardiopulmonares. En el estudio de Markos et al49, el VO'2máx no fue diferente entre los pacientes con y sin complicaciones. Sí lo fueron, sin embargo, el FEV1-ppo, la TLCO, la TLCO-ppo y la desaturación durante el ejercicio. En este estudio la mitad de los pacientes tenían un FEV1 > 2 l, y sólo el 6% un FEV1 < 50%. Ribas et al57, al estudiar a pacientes de alto riesgo con criterios espirométricos, encontraron resultados equiparables.
Algunos estudios se han planteado describir las tasa de morbilidad y mortalidad en pequeñas muestras de pacientes considerados inoperables con criterios de función predicha postoperatoria, pero cuyo V.O2máx superaba los 10 ml/min/kg o los 15 ml/min/kg con resultados satisfactorios67-69.
No está clara la razón de las discrepancias entre los estudios que han tratado de relacionar el V.O2máx con la morbilidad o mortalidad postoperatorias. En algunos casos pudieron deberse a divergencias en la selección de pacientes que resultaron en diferencias en la función cardíaca o pulmonar de la muestra estudiada. También hay diferencias en el tipo de complicaciones que se consideraron, en las que realmente se presentaron en los pacientes estudiados y en los criterios de diagnóstico. Pudo haber diferencias en la metodología de la prueba de esfuerzo o en la colaboración de los sujetos. Finalmente, pudieron variar los medios aplicados para prevenir y tratar las complicaciones.
Umbral de lactato
En el estudio de Miyoshi et al70, el V.O2 por m2 de superfice corporal en el que se encontraba una cierta concentración de lactato (20 mg/dl) predecía la mortalidad, aunque no la morbilidad. El mismo grupo describió en un estudio de 31 pacientes que el mejor índice de los que analizaron para predecir la mortalidad era el aporte de oxígeno cuando el lactato era de 20 mg/dl. En otra publicación63 hallaron que los pacientes que tenían V.O2LT > 15 ml/min/kg no presentaron ninguna complicación.
Estudios hemodinámicos en ejercicio
Los estudios de oclusión de la arteria pulmonar en ejercicio se han indicado desde hace años sin que se haya demostrado su utilidad. Aunque se ha publicado que las variaciones en la fracción de eyección de ventrículo izquierdo durante el ejercicio se correlacionan con la morbilidad postoperatoria en resección pulmonar71, en diversos estudios actuales revisados no hay evidencia de que ningún estudio hemodinámico en ejercicio supere a otros estudios menos invasivos para predecir el riesgo, y por tanto no son recomendables57,67,72,73.
Desaturación con el ejercicio
Son muchos los estudios que han encontrado una relación entre la desaturación con el ejercicio74 y el riesgo postoperatorio, aunque otros autores42,75 no encontraron que la desaturación predijera la complicaciones, aunque sí el FEV1-ppo.
La desaturación en ejercicio parece relacionarse con un alto riesgo de complicaciones cardiorrespiratorias. No hay evidencias suficientes para saber si, como criterio, es mejor que otros basados en el V.O2máx > 15 ml/min/kg o en las estimaciones de la función postoperatoria del FEV1-ppo o la TLCO-ppo.
Riesgo quirúrgico en función de la intervención
Técnica anestésica
La técnica anestésica adecuada durante la resección pulmonar por CB es un factor tan importante que modifica significativamente el riesgo del procedimiento. Con un anestesiólogo experto en este tipo de cirugía, los pacientes considerados de muy alto riesgo pueden someterse a resección pulmonar con relativa seguridad. Además, diversas innovaciones técnicas76 --que escapan al contenido de estas recomendaciones-- tienen también una influencia decisiva.
Fisiopatología. Durante la toracotomía se producen una serie de modificaciones fisiológicas que pueden agravar una alteración funcional respiratoria previa del paciente.
1. Modificaciones de la relación ventilación/perfusión. El decúbito lateral provoca que el pulmón proclive sea el más ventilado y el declive el mejor perfundido, por gravedad. Además, durante la anestesia general se pierde el tono diafragmático, lo que, unido a la posición en decúbito, hace que disminuyan los volúmenes pulmonares debido a la posición más elevada del diafragma. Se reduce así la capacidad residual funcional (CRF) --entre el 16 y el 20%, independientemente del anestésico utilizado--, el volumen de reserva espiratoria y la compliancia pulmonar. La capacidad de cierre disminuye en la misma medida que la CRF, por lo que el riesgo de cortocircuito intrapulmonar es el mismo.
La disminución de la CRF sitúa al pulmón superior en la zona favorable de la curva presión/volumen, es decir, es más elástico y, por tanto, la presión positiva que se produce durante la ventilación mecánica permite que se distienda mejor.
2. Ventilación de un solo pulmón. La cirugía torácica requiere el colapso del pulmón proclive, por lo que en un principio este pulmón deja de ventilar pero mantiene su flujo sanguíneo, que no se oxigena. Por tanto, el gradiente alveoloarterial de oxígeno aumenta y se produce un incremento del 20 al 30% del shunt derecha-izquierda y, con ello, hipoxemia77. Ante esta situación el organismo pone en marcha un mecanismo de compensación --la vasoconstricción pulmonar hipóxica78-- que deriva el flujo del pulmón proclive, no ventilado, al declive, ventilado; el shunt disminuye y mejora el intercambio gaseoso. La intolerancia al colapso pulmonar se ha podido sospechar y evaluar preoperatoriamente; sin embargo, los anestesiólogos pueden utilizar diferentes maniobras para mejorar dicha oxigenación. Entre las más efectivas se encuentra el aumento de la fracción inspiratoria de O2 (FiO2), la insuflación periódica del pulmón colapsado y la presión positiva continua de 5 a 10 cmH2O de dicho pulmón colapsado, aunque esto puede interferir con la cirugía79.
Tipo de abordaje quirúrgico
El abordaje quirúrgico para la resección pulmonar puede hacerse en la actualidad mediante 3 procedimientos: toracotomía estándar, toracotomía sin sección muscular y toracotomía videoasistida.
Existe evidencia en la bibliografía médica de que los procedimientos videoasistidos reducen la producción de reactantes de fase aguda en el postoperatorio inmediato, en comparación con otros procedimientos más agresivos80-82, aunque se desconoce qué implicaciones clínicas puede tener este hecho.
Respecto a la relación entre el tipo de abordaje y el riesgo quirúrgico, algunos autores afirman que la cirugía videoasistida reduce los efectos adversos de la resección pulmonar81,83,84. Sin embargo, esto no se ha podido demostrar en ensayos clínicos aleatorizados85, y ni siquiera existe evidencia de que el abordaje sin sección muscular --comparado con la toracotomía estándar-- se correlacione con una evolución postoperatoria más favorable86.
Tipo de cirugía realizada
La extensión de la cirugía está directamente relacionada con las tasas de morbilidad y mortalidad87. Sin embargo, no es una variable independiente de la función respiratoria ni de la capacidad del paciente para el ejercicio. Además, la extensión de la resección se relaciona directamente con el estadio tumoral.
La resección segmentaria, especialmente la segmentectomía atípica, está recomendada para pacientes con tumores pequeños, periféricos, que no pueden tolerar una lobectomía. Sin embargo, el conocido ensayo clínico del Lung Cancer Study Group88 demostró que 1 año después de la cirugía desaparecen las ventajas de la segmentectomía frente a la lobectomía respecto a la disminución de los volúmenes pulmonares. Además, hay datos de que, en pacientes con EPOC, la repercusión de la lobectomía sobre los volúmenes pulmonares es mínima89. Sin embargo, el artículo de Keenan et al90 concluye que la resección segmentaria produce un menor deterioro de la función pulmonar (aunque estudia 2 series de casos no comparables).
Si el riesgo quirúrgico es extremo y el tumor muy pequeño, probablemente la comorbilidad tiene peor pronóstico que el cáncer, por lo que la resección del tumor no está indicada.
La neumonectomía aparece como un factor de riesgo significativo en la mayor parte de los análisis multivariantes realizados que buscan los factores determinantes de la morbimortalidad14,36,87,91-93. Es interesante saber que la mortalidad es mayor tras una neumonectomía derecha que tras una izquierda87,92,94,95. Por ejemplo, Wahi et al96 registraron un índice de mortalidad del 12% en la derecha frente a sólo el 1% en la izquierda. La razón no está completamente definida, pero parece que tiene que ver con la mayor reducción de la función respiratoria y el riesgo aumentado de que se produzca una fístula bronquial, empiema y edema pulmonar posresección97.
La aparición de una fístula bronquial postoperatoria es causa de muerte, según un autor, en el 70% de los pacientes que la presentan98. Además, factores relacionados de forma significativa con el desarrollo de una fístula bronquial son: la presencia de tumor en el muñón bronquial, la necesidad de ventilación mecánica prolongada en el postoperatorio y la disección ganglionar mediastínica99. De nuevo, nos encontramos con que el riesgo de la neumonectomía se asocia con otras variables como la extensión tumoral.
Las técnicas broncoplásticas son una alternativa válida a la neumonectomía para el tratamiento de lesiones bronquiales centrales benignas o malignas, sobre todo si el paciente tiene una función pulmonar límite. Se ha comprobado que la supervivencia de los pacientes con CB y una resección broncoplástica es similar a la que ofrece la resección estándar73,100-103. Aunque se han descrito un 10,3% de recidivas locales tras la resección broncoplástica104, la tasa de morbimortalidad postoperatoria es similar102,104 o inferior103 a la registrada en las neumonectomías, lo que supone una clara ventaja101. Por supuesto, la incidencia de insuficiencia respiratoria post-operatoria es significativamente superior en el grupo de neumonectomizados (el 7 frente al 1,7%)102.
Cuando en la resección se incluyen otros órganos o estructuras torácicas además del pulmón, se describe un aumento del número de complicaciones respiratorias mayores respecto a las resecciones estándar, lo que también hace aumentar de forma significativa la tasa de mortalidad105,106. Por ejemplo, en la serie publicada en 1994 por Busch et al107 la mortalidad según el procedimiento no era significativamente diferente, excepto al considerar las resecciones extendidas, en cuyo caso la mortalidad ascendía hasta el 25% en las lobectomías. Además, las complicaciones respiratorias fueron responsables directas del 33% de la mortalidad y contribuyeron de alguna manera al 50% de los pacientes con resecciones extendidas que fallecieron.
Cuidados postoperatorios
Lo mismo que se ha comentado respecto a la técnica anestésica sucede con el tipo de cuidados postoperatorios, puesto que el personal de enfermería o fisioterapia respiratoria puede modificar significativamente las cifras de mortalidad y morbilidad operatorias.
Prevención de las alteraciones ventilatorias. La extubación precoz contribuye a disminuir el barotrauma y las posibilidades de infección. Cuando no es posible, se debe cambiar el tubo de doble luz por uno estándar que permita una limpieza bronquial más correcta.
El trabajo respiratorio se incrementa en el postoperatorio inmediato tanto como desciende la elasticidad pulmonar en relación con la cantidad de tejido resecado. La acumulación de secreciones bronquiales, las micro-atelectasias, el incremento en el agua pulmonar y la disminución en la actividad del tensioactivo agravan esta situación108-110. Paralelamente, la fuerza máxima que puede desarrollar el diafragma se encuentra reducida, y por otro lado la toracotomía posterolateral implica una mayor reducción postoperatoria de la fuerza muscular respiratoria, especialmente en los pacientes ancianos, en los que la recuperación postoperatoria de la fuerza de sus músculos respiratorios es más lenta109,111.
Hipoxemia y acidosis respiratoria son, pues, hallazgos frecuentes entre el primer y tercer día del postoperatorio torácico y suelen ser debidos, como se acaba de comentar, a atelectasias, respiración superficial por dolor y trasudación de líquido con edema pulmonar tras reexpansión del pulmón colapsado; por esto, como señalan Watkins y Lumb112, se debe tener en cuenta una serie de medidas generales tales como mantener al paciente en posición semisentado y con oxígeno suplementario (FiO2 = 0,4-0,5), bajo vigilancia respiratoria y hemodinámica, control de hipotermia durante al menos 24 h, así como permitir una analgesia adecuada. Sin embargo, estas alteraciones retornan a niveles normales habitualmente a lo largo de la primera semana, aunque al quinto día todavía el 50% de los pacientes pueden permanecer hipoxémicos. No obstante, hay una baja correlación entre la intensidad de la alteración del intercambio gaseoso y la presencia de complicaciones pulmonares detectables113,114.
No hay en la bibliografía evidencia de que las maniobras postoperatorias de fisioterapia respiratoria ni la espirometría incentiva di sminuyan el riesgo de complicaciones después de una resección pulmonar115, probablemente porque nunca se ha llevado a cabo un estudio similar. Sí se ha demostrado que el entrenamiento muscular preoperatorio mejora la función pulmonar en pacientes de riesgo que van a someterse a resección116.
Alteraciones circulatorias y transfusión de sangre y derivados. El equilibrio hídrico debe ser especialmente cuidadoso en pacientes sometidos a neumonectomía, fundamentalmente derecha, para prevenir el edema pulmonar posneumonectomía, aunque en su génesis parece ser que también intervienen otros factores como la cirugía prolongada, las hiperinsuflaciones y las distensiones del parénquima y las transfusiones, sobre todo cuando son frías117.
La necesidad de transfusión sanguínea en pacientes sometidos a cirugía torácica suele relacionarse con problemas vasculares perioperatorios o, más frecuentemente, con técnicas complejas y muy hemorrágicas desde el punto de vista técnico. Algunos autores afirman que la prevalencia de hemorragia en intervenciones torácicas es del 16%118. Aun así, en la cirugía torácica programada es necesario tipificar y cruzar sangre inicialmente, y más tarde evaluar si hay factores de riesgo que hacen necesario administrar hematíes para mejorar el aporte de O2, así como las distintas posibilidades de administrarlos. Se recomienda mantener canalizada una vía de calibre grueso durante el postoperatorio y disponer de un calentador de sangre y un sistema de infusión rápida. La mayoría de los clínicos deciden trasfundir cuando el nivel de hemoglobina es < a 7-8 g/dl119, exceptuando los pacientes con infarto de miocardio o angina inestable, en los que se suele preferir una hemoglobina mínima de 10 g/dl120, ya que no hay evidencia de que la anemia leve o moderada incremente la morbilidad perioperatoria.
Analgesia. La analgesia no sólo mejora el confort del paciente sino que permite la realización de fisioterapia respiratoria, así se evita la acumulación de secreciones y, por tanto, la incidencia de atelectasias y sobreinfecciones. En general, las técnicas regionales parecen mejores que la analgesia intravenosa, ya que evitan la depresión respiratoria, sobre todo en los pacientes con función pulmonar disminuida. Se puede usar analgesia por vía epidural o paravertebral tanto con anestésicos locales como con opiáceos. La vía paravertebral121 en principio está más indicada porque, además de presentar menor posibilidad de hematoma peridural, ya que no se actúa sobre la línea media, localiza la analgesia en el hemitórax intervenido. Ambas deben asociarse con antiinflamatorios no esteroideos intravenosos, dada la probada eficacia de las técnicas multimodales. Otra opción es el bloqueo de nervios intercostales realizado por el propio cirujano al final, o mejor al principio, de la intervención, ya que proporciona una excelente analgesia durante el postoperatorio más inmediato. Por otro lado, la anestesia intrapleural122 no goza de tan buena reputación, ya que ningún estudio ha conseguido demostrar sus beneficios.
Efectos adversos de otros fármacos. Además de los opiáceos y sedantes, otros fármacos que pueden producir efectos adversos a nivel central son123:
- Los antihistamínicos H2, la cimetidina y la lidocaína pueden inducir, como efecto colateral, depresión respiratoria.
- Los fármacos que producen alcalosis respiratoria (bicarbonatos, diuréticos) también pueden reducir la estimulación respiratoria.
- Hay otros medicamentos, como el captopril o la amiodarona, que pueden desencadenar neuropatías. Como señalan Aldrich y Prezant123, hay múltiples medicamentos que pueden desencadenar bloqueo neuromuscular como efecto colateral, entre los que se puede destacar: antibióticos (aminoglucósidos, penicilinas, macrólidos, tetraciclinas), bloqueadores de los canales del calcio (con efecto fundamentalmente sobre el diafragma), esteroides (por inhibición postsináptica de la transmisión neuromuscular) y, lógicamente, relajantes musculares.
Influencia de la quimioterapia de inducción
La utilización cada vez más frecuente de terapias multimodales en pacientes con CB y, sobre todo, la quimioterapia de inducción124 hacen que sea necesaria su consideración en el apartado de la morbimortalidad, ya que pueden influir en el incremento del riesgo quirúrgico. En algunas publicaciones se ha señalado que este tratamiento produce un incremento de la morbimortalidad31,125, sobre todo de tipo infeccioso y cardiovascular, fundamentalmente en pacientes sometidos a neumonectomía. Sin embargo, este hallazgo no se ha confirmado en otros estudios126.
Recientemente se ha publicado que en los pacientes sometidos a quimioterapia de inducción los volúmenes pulmonares no son buenos indicadores del riesgo quirúrgico y se recomienda, en todos los casos, medir la difusión127.
Recomendaciones
Consideraciones generales
Las consideraciones que figuran en este manual no pueden tomarse como criterios absolutos. No existen límites indiscutibles para la operabilidad del paciente con CB, y cualquier caso dudoso se debe someter a discusión individualizada por un equipo interdisciplinario en el que participen todos los facultativos implicados en el proceso (cirujanos torácicos, anestesiólogos, intensivistas, neumólogos, oncólogos...).
Situación general y comorbilidad
- La edad del paciente, por sí sola, no es una variable que permita decidir la inoperabilidad.
- En pacientes octogenarios se desaconsejan la neumonectomía y la lobectomía ampliada.
- Se desaconseja cualquier resección pulmonar en pacientes con un índice ECOG-WHO ≥ 2 o Karnofsky ≤ 50%.
- Cualquier comorbilidad con un pronóstico demostrado peor que el del CB sin tratamiento quirúrgico debe considerarse un criterio de inoperabilidad.
- En presencia de estenosis carotídea o coronaria con indicación quirúrgica, esta cirugía debe realizarse antes de la resección pulmonar.
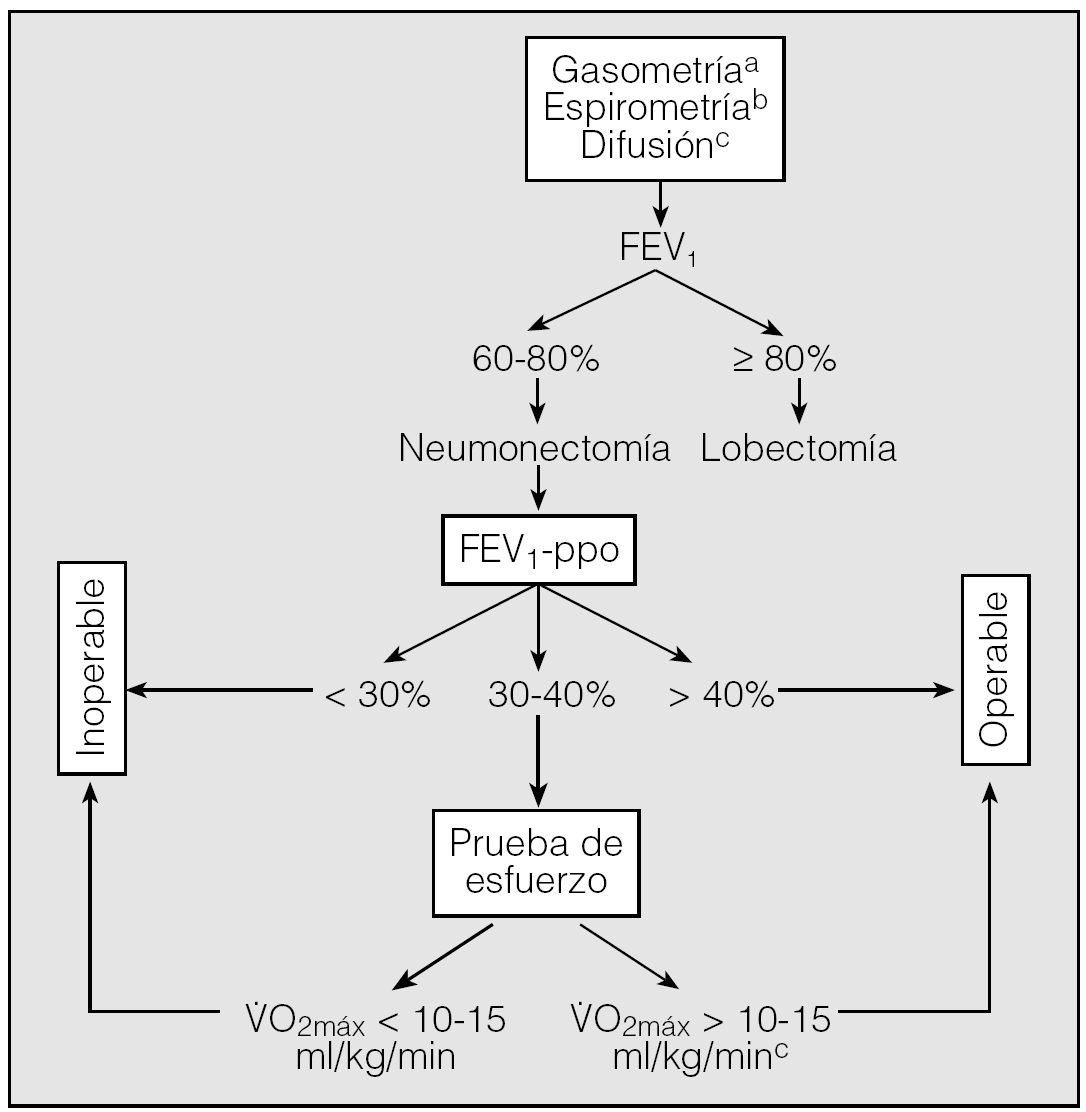
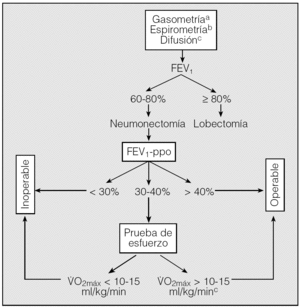
Evaluación de la función pulmonar (fig. 1)
Fig. 1. Algoritmo para la evaluación del riesgo quirúrgico en pacientes candidatos a cirugía de resección pulmonar. (Los criterios resumidos en este algoritmo no deben considerarse indiscutibles. No existen límites absolutos y cualquier caso dudoso se debe evaluar por un equipo multidisciplinar.)FEV1: volumen espiratorio forzado en el primer segundo; FEV1-ppo: volumen espiratorio forzado en el primer segundo predicho postoperatorio; V.O2máx: consumo de oxígeno en esfuerzo máximo.aLos valores gasométricos no constituyen un criterio absoluto de operabilidad.bEl cálculo de la TLCO es recomendable en todos los casos y obligado en pacientes con disnea no justificable por los volúmenes pulmonares, enfermedad intersticial o quimioterapia de inducción. cAunque el paciente pueda considerarse operable, no lo es sin un riesgo importante.
- Todos los pacientes en los que se indiqueón pulmonar por CB se deben estudiar mediante gasometría arterial y espirometría forzada.
- El estudio de difusión es recomendable en todos los casos y obligatorio en pacientes con patología pulmonar intersticial, disnea no justificable y/o quimioterapia de inducción, independientemente de los valores de los volúmenes pulmonares.
- La función pulmonar debe evaluarse cuando los pacientes están clínicamente estables y con la máxima broncodilatación, después de un período de abstinencia tabáquica. Es obligatorio optimizar el tratamiento farmacológico antes de la cirugía.
- Si el FEV1 es > 80% del teórico no se precisan más pruebas adicionales. En las demás situaciones se debe calcular el FEV1-ppo para la resección propuesta.
- Para el cálculo de la función pulmonar postoperatoria se recomienda utilizar la gammagrafía pulmonar de perfusión con 99Tc en posiciones PA y AP. En su defecto, es aceptable el cálculo basado en el número de segmentos pulmonares funcionantes que se van a resecar.
- Si la difusión es < 60% del valor teórico (al 50% para la lobectomía), es necesario realizar otras pruebas para el cálculo de la función pulmonar postoperatoria.
- Si el FEV1-ppo es < 30% del valor teórico, se desaconseja la cirugía.
Pruebas de esfuerzo
- En pacientes con FEV1-ppo y/o TLCO < 40% se debe indicar una prueba de consumo de oxígeno en ejercicio.
- Un V.O2máx ≥ 10-15 ml/min/kg identifica pacientes operables, aunque con un riesgo operatorio importante.
- Un V.O2máx ≤ 10-15 ml/min/kg contraindica la cirugía de resección pulmonar.
- No se recomienda ningún estudio hemodinámico invasivo en la evaluación del riesgo de la resección pulmonar.
Técnicas y tratamiento perioperatorio
- No existe evidencia científica de que la resección pulmonar en cuña sea un procedimiento que ofrezca un adecuado equilibrio riesgo/efectividad en el tratamiento del CB.
- No existe evidencia científica de que la cirugía mínimamente invasiva disminuya la morbilidad ni la mortalidad operatoria en la población general sometida a resección pulmonar. Sin embargo, por su menor influencia en la concentración sérica de reactantes de fase aguda, se recomienda su práctica en pacientes de riesgo elevado.
- Se recomienda evitar la neumonectomía mediante técnicas broncoplásticas, siempre que se considere técnicamente posible y oncológicamente adecuado.
- Se desaconseja la práctica de la resección pulmonar por CB en equipos quirúrgicos que no cuenten con cirujanos, anestesiólogos y personal de enfermería y fisioterapia entrenados específicamente en estas técnicas.