Introducción
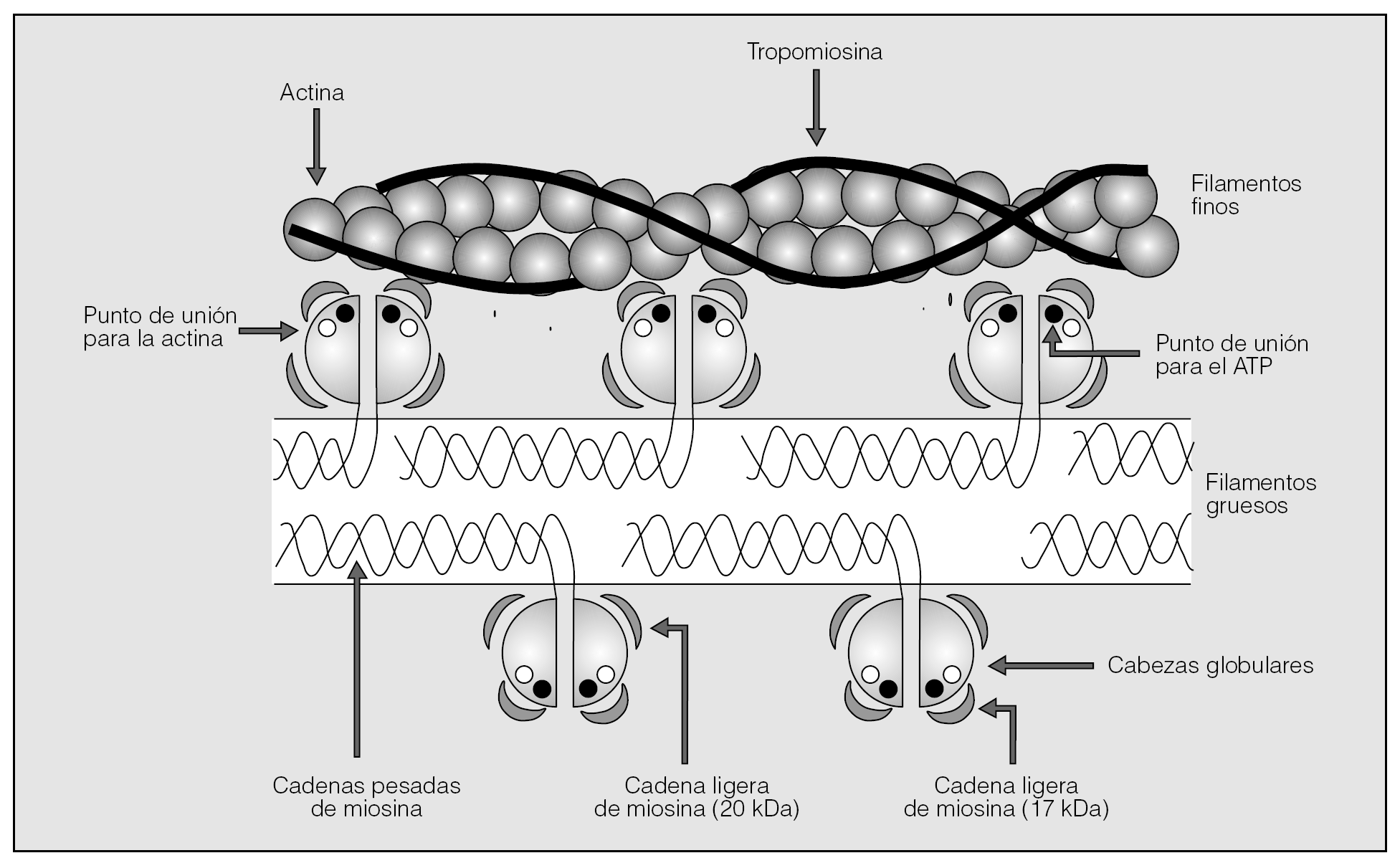
El músculo liso de la vía aérea (MLVA) es una célula mesenquimal habilitada para expresar una notable plasticidad fenotípica, cuya contracción y relajación están sometidas a regulación neurohumoral y moduladas por un complejo conjunto de mecanismos diseñados para funcionar de manera integrada y contrabalancearse1,2. Su maquinaria contráctil está constituida básicamente por: a) filamentos gruesos paralelos de miosina; b) filamentos finos formados mediante unidades repetidas de actina, con una disposición longitudinal y una doble cadena helicoidal de tropomiosina dispuesta en el surco que dejan las cadenas de actina, y c) otras estructuras proteínicas (cuerpos densos, filamentos intermedios y filamina), sin naturaleza contráctil, pero que aportan cierta rigidez al miocito y son responsables, en parte, del mantenimiento del tono3. La miosina es un hexámero que contiene un par de cadenas asimétricas pesadas (200-204 kDa), cada una de las cuales con sendas cadenas ligeras de miosina (CLM) de 17 y 20 kDa. Las cadenas pesadas se asemejan a bastones de golf, de forma que es posible distinguir un cuerpo, en el que los bastones se enrollan entre sí en espiral, y dos cabezas globulares con sus cadenas ligeras asociadas, dispuestas como proyecciones laterales que sobresalen fuera del filamento; las cadenas ligeras se ubican 2 a cada lado de estas cabezas globulares3 (fig. 1).
Fig. 1. Representación esquemática de las proteínas contráctiles del músculo liso que muestra los componentes básicos de los filamentos gruesos de miosina y los filamentos finos de actina.
De acuerdo con la teoría de la contracción muscular por deslizamiento de los filamentos, el desarrollo de la tensión y contracción del MLVA aparece como resultado de las interacciones actina-miosina que producen movimientos relativos entre los filamentos gruesos y delgados3-5. Para que eso ocurra es necesaria la activación previa de una enzima, la miosincinasa de cadenas ligeras (MCCL), que fosforila las CLM. La miosina fosforilada cataliza, en presencia de actina, la hidrólisis de adenosín trifosfato (ATP) a adenosín difosfato (ADP), y la liberación de energía subsiguiente posibilita el desplazamiento de los filamentos de actina a lo largo de la miosina3-5.
La presente revisión tiene como objetivo actualizar la información hoy disponible sobre las sustancias que tienen la capacidad de relajar el MLVA y aumentar así el calibre de la luz bronquial. Este grupo farmacológico, con el nombre genérico de broncodilatadores, engloba a agentes de muy diversa naturaleza. De todos ellos, en nuestra opinión, los agonistas simpaticomiméticos β2 son los que continúan despertando mayor interés entre los investigadores, y en ellos los avances en el conocimiento de sus receptores específicos (polimorfismos y consecuencias de la sobreexpresión de dichos receptores) parecen sin duda más prometedores cara al futuro. No obstante, antes de centrarnos en ambos temas, parece aconsejable describir con cierta profundidad el proceso de la contracción del MLVA y los mecanismos generales implicados en su relajación.
Señales intracelulares y bioquímica de la contracción del músculo liso
Desde hace tiempo se sabe que la concentración de Ca2+ intracitoplásmico ([Ca2+]i) constituye la señal intracelular que en buena medida determina el grado de contracción y relajación el músculo liso2,5. En condiciones de reposo, la [Ca2+]i es muy inferior a la del espacio extracelular (1-2 mM frente a 150 nM). Esta diferencia facilita su entrada al interior de la célula, aunque los valores finales se mantienen bastante constantes gracias a una serie de mecanismos homeostáticos: a) intercambio transmembrana Na+/Ca2+; b) expulsión al exterior mediante una bomba Ca2+-ATPasa, y c) captación en el retículo sarcoplásmico4,6.
Sólo cuando la [Ca2+]i llega a superar en 4-10 veces los valores basales, tiene lugar la unión del ion Ca2+ con su receptor intracelular, la calmodulina, que es una proteína de estructura molecular semejante a la de la troponina C del músculo esquelético6. Cuatro moles de Ca2+ se ligan a cada mol de aquélla, y el complejo Ca2+-calmodulina formado se une a la subunidad catalítica de la MCCL, generando un complejo holoenzimático Ca2+-calmodulina-MCCL que posibilita la transferencia de un grupo fosfato, desde el complejo Mg-ATP a las CLM4,6. Las CLM fosforiladas serán posteriormente desfosforiladas por una fosfatasa de CLM (MFCL), de modo que, en principio, la cantidad de CLM fosforilada depende del equilibrio existente entre MCCL y MFCL7. La actividad de la MCCL queda inhibida por una proteincinasa II dependiente de Ca2+-calmodulina, que es estimulada por el propio incremento de la [Ca2+]i7.
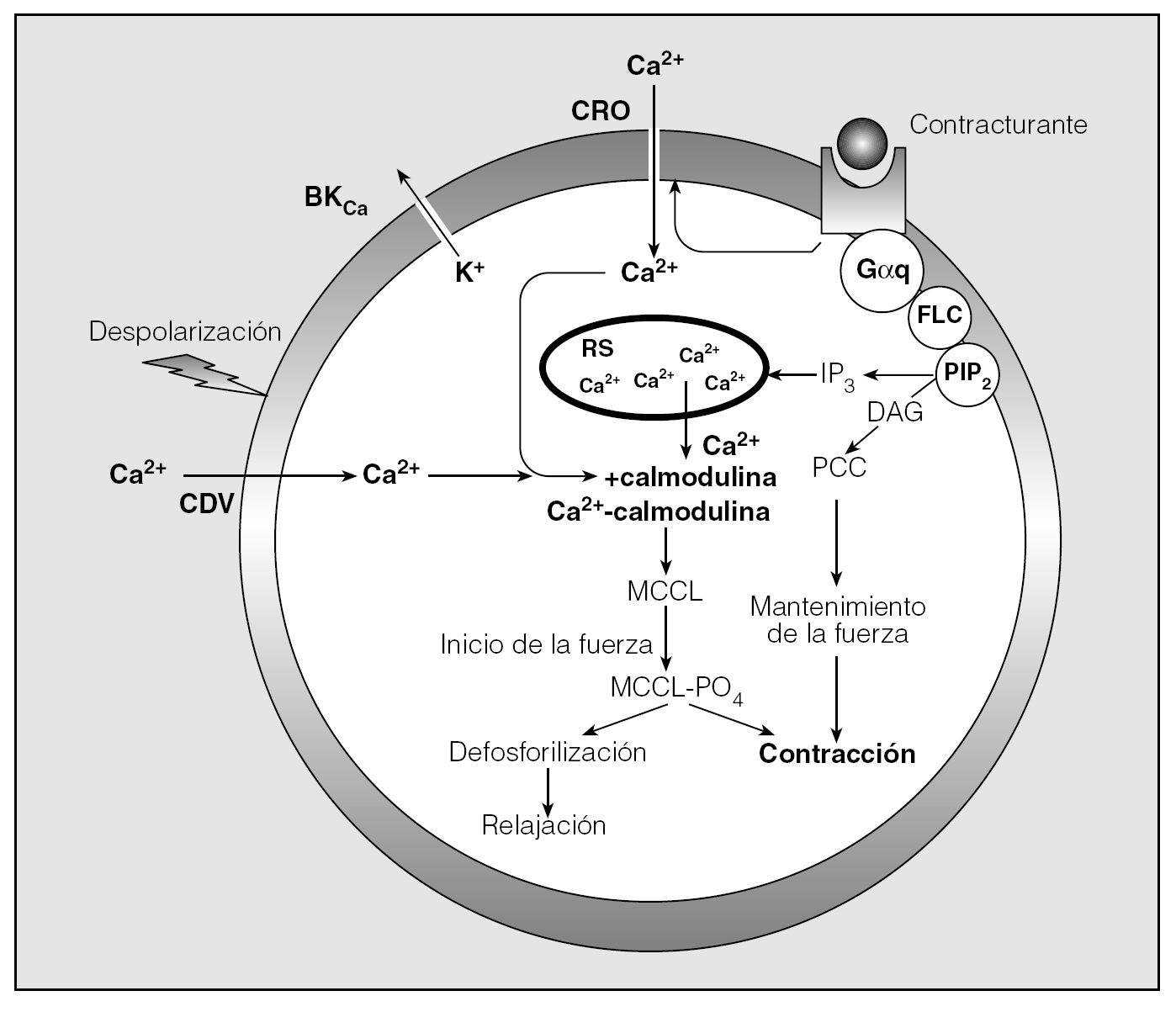
El aumento crítico de la [Ca2+]i que acabamos de señalar tiene un doble origen: la entrada de Ca2+ desde el espacio extracelular a través del sarcolema y la liberación de Ca2+ a partir de organelas citoplásmicas, fundamentalmente el retículo sarcoplásmico (RS)8. La importancia y la participación de uno u otro mecanismo varían según sea la naturaleza del estímulo aplicado6. Así, cuando el miocito se ve expuesto a estímulos eléctricos o a concentraciones elevadas de K+ (acoplamiento electromecánico), la despolarización de la membrana celular determina la apertura en ella de un tipo concreto de canales de Ca2+ conocidos como canales dependientes de voltaje (CDV) (fig. 2). Existen al menos 6 clases de CDV (L, N, P, Q, R y T), pero en el músculo liso el que tiene relevancia es el tipo L4.
Fig. 2. Esquema de los movimientos del Ca2+ en la célula muscular lisa durante su contracción. En los casos de acoplamiento electromecánico (ClK, estímulo eléctrico), el aumento de la [Ca2+]i se produce por la apertura de los canales de Ca2+ dependientes de voltaje (CDV). Los agonistas contracturantes (acoplamiento farmacomecánico) provocan la liberación del Ca2+ almacenado en el retículo sarcoplásmico (RS) y su entrada desde el espacio extracelular a través de canales de Ca2+ activados por receptor (CRO). (Para el resto de las abreviaturas y la descripción pormenorizada de todo el proceso, véase el texto.)
Sin embargo, la consecuencia a que da lugar la estimulación del MLVA por los contracturantes "clásicos", como histamina o metacolina (acoplamiento farmacomecánico), resulta bastante más compleja. En estos casos, en los que los receptores de los agonistas están acoplados a la proteína G, la unión ligando-receptor determina la activación de la subunidad * de dicha proteína G (Gαq)6,8, que unida a guanosín trifosfato (GTP) activa en la membrana citoplásmica una fosfolipasa C (FLC) capaz de catalizar la hidrólisis del fosfatidil inositol 4,5 bifosfato (PIP2) y generar la síntesis de 2 señales intracelulares adicionales: el 1,2 diacilglicerol (DAG), que a su vez estimula a una proteincinasa C (PCC), y el inositol 1,4,5 trifosfato (IP3)6,8,9. El IP3 difunde al citosol para actuar sobre receptores específicos localizados en la membrana del RS, que es, con las mitocondrias, el depósito más importante de Ca2+ en el miocito y donde basalmente permanece neutralizado por proteínas (calreticulina y calsecuestrina) que pueden tamponar grandes cantidades del mismo4. La activación del receptor IP3 determina la apertura de canales específicos para el Ca2+ presentes en esta estructura, y la salida del ion al sarcoplasma a favor de gradiente modificará la [Ca2+]i6,8,9 (fig. 2). Se ha identificado otro tipo de canales de Ca2+ en la membrana del RS, sensibles a la rianodina, del que se han clonado al menos tres isoformas y cuya activación depende de la propia [Ca2+]i. La liberación de Ca2+ a través de los canales ligados a los receptores a rianodina produce aumentos importantes, transitorios y localizados en la [Ca2+]i (sparks de Ca2+)7,10,11. Cuando estos sparks ocurren próximos a la membrana citoplásmica, actúan como reguladores de su conductancia iónica (véase posteriormente), y la agrupación de varios sparks simultáneos da lugar a ondas de Ca2+ que recorren la célula10,11. La formación del complejo fármaco-receptor, además, puede incrementar la [Ca2+]i abriendo los CDV-L directamente o indirectamente a través de la despolarización de la membrana inducida por la apertura de canales no selectivos de cationes, la inhibición de los canales de K+ de gran conductancia dependientes de Ca2+ (canales maxi-K) y canales de K+ dependientes del voltaje, o la activación de los canales de Cl, inmersos en el sarcolema del miocito7.
Los cambios en la [Ca2+]i, de todos modos, no explican toda la respuesta contráctil inducida por el acoplamiento farmacomecánico, ya que los agonistas y segundos mensajeros modifican la relación MCCL/MFCL con independencia de la [Ca2+]i7. La experimentación realizada sobre el músculo liso vascular ha sido la que más ha ayudado a comprender esta circunstancia especial, al demostrar que, en presencia de contracturantes, como la noradrenalina, el reactivo desarrolla una respuesta en dos etapas: un aumento inicial y rápido del tono, seguido de una contracción lenta y sostenida12. El incremento de la [Ca2+]i aparece en el primer momento pero es transitorio ya que el Ca2+ vuelve a ser recaptado por el RS o expulsado fuera de la célula. Como resultado de ello, la tasa de fosforilación de las CLM y la [Ca2+]i descienden durante la segunda fase de la respuesta contráctil hasta valores sólo algo superiores a los detectados basalmente7,12. Esta secuencia de hechos ha llevado a concluir que la fase tónica se produce por la aparición de una mayor sensibilidad al Ca2+ en los elementos contráctiles7. Los mecanismos que desencadenan la sensibilización no están del todo bien definidos y posiblemente sean distintos en función del tipo de músculo liso. Karaki et al apuntan las siguientes alternativas7: a) la inhibición inducida por el complejo agonista-receptor de la proteincinasa II dependiente de Ca2+-calmodulina; b) la inactivación de la MFCL, también provocada por la unión agonista-receptor, vía ácido araquidónico o mediante una pequeña proteína que contiene GTP (proteína rho); c) los cambios en la concentración de calmodulina, y por último, pero de gran interés, d) la fosforilación de la calponina (CAL) por parte de una isoforma de la proteincinasa C (PCC*). La CAL, junto al caldesmón, la desmina, la sinemina y la filamina, es una proteína descrita en el MLVA (y en otras localizaciones), asociada a los filamentos delgados de actina, capaz de interactuar también con la calmodulina y la miosina, y que parece desempeñar un papel destacado en el control de la contracción del músculo liso al inhibir la actividad miosin ATPasa inducida por la actina, sin afectar a la fosforilación de las CLM4,13. La PCC2 actuaría, vía proteincinasa mitógeno activada, fosforilando la CAL que, entonces, se disocia de la actina y pierde su efecto sobre la miosin ATPasa4,13,14 (fig. 2). En un paso ulterior, la CAL será de nuevo defosforilada mediante una fosfatasa específica (PF2A)4,10.
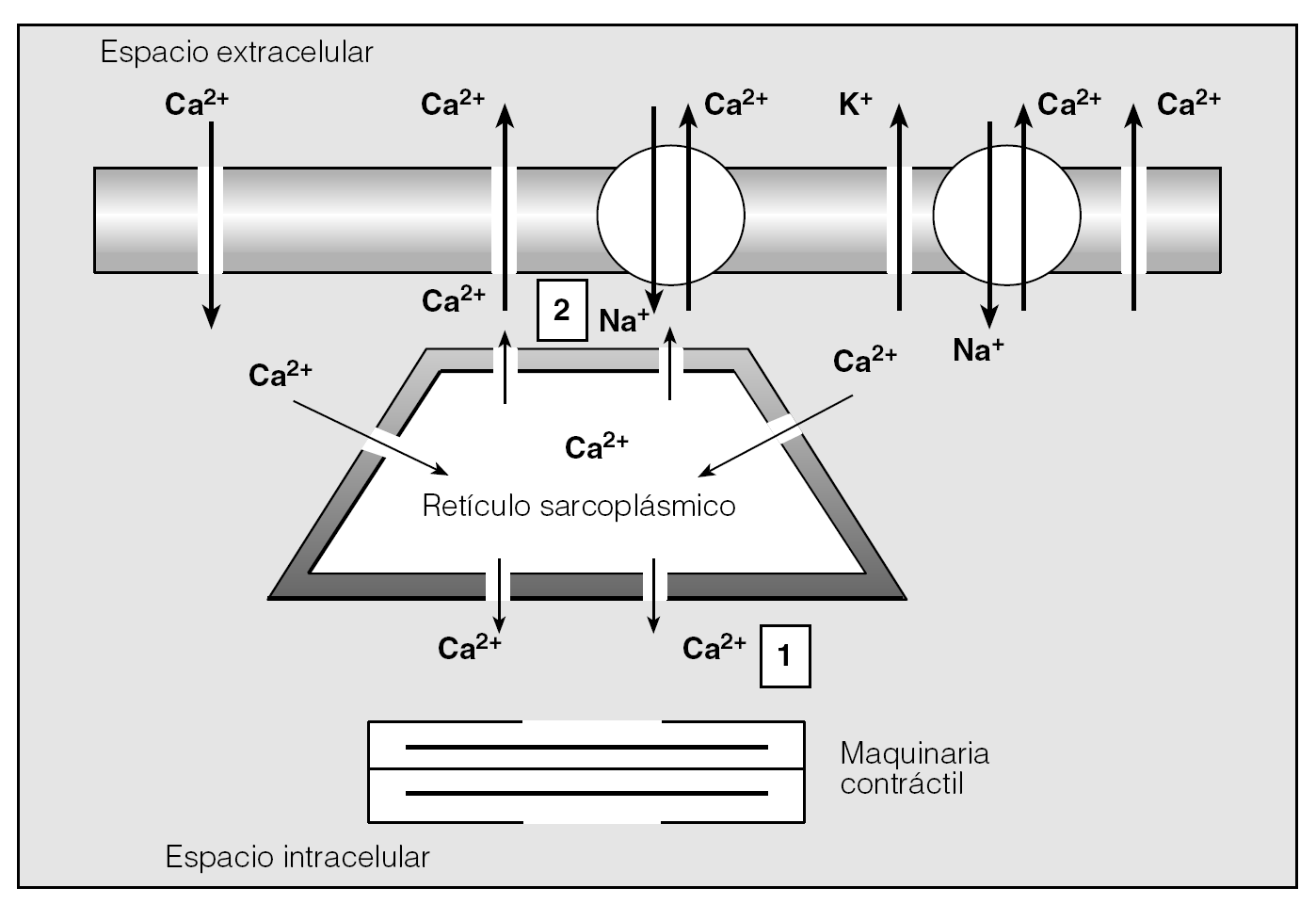
Un dato final que cabe destacar es que el Ca2+ libre citoplásmico del MLVA no guarda una distribución homogénea sino que se encuentra contenido en diversas áreas del miocito delimitadas por las capas de RS existentes a lo largo de la periferia de la célula y próximas a la membrana citoplásmica4,7,15. Básicamente, cabe distinguir 2 compartimientos fundamentales (fig. 3)7,10. El primero es el espacio citoplásmico ubicado en el centro de la célula, por debajo del RS superficial y rodeando los elementos contráctiles; el Ca2+ de este lugar es el responsable directo de la contracción7,10. El segundo está localizado en el estrecho espacio existente entre el RS superficial y el plasmalema. El Ca2+ que es liberado aquí desde el RS se expulsa rápidamente al exterior de la célula y su difusión al interior del miocito se encuentra muy restringida7. Los sparks de Ca2+ antes mencionados actúan a modo de feed-back negativo de la contracción ya que: a) activan los intercambiadores Na+/Ca2+ y las bombas de extrusión de Ca2+ de la membrana citoplásmica, y b) estimulan a los canales de K+, lo que conduce a hiperpolarizar el sarcolema e inhibir la transducción de la señal mediada por el receptor7,10-12.
Fig. 3. Heterogeneidad y distribución espacial del Ca2+ libre citoplásmico en la célula muscular lisa. (Véase texto.)
Mecanismos generales de la broncodilatación
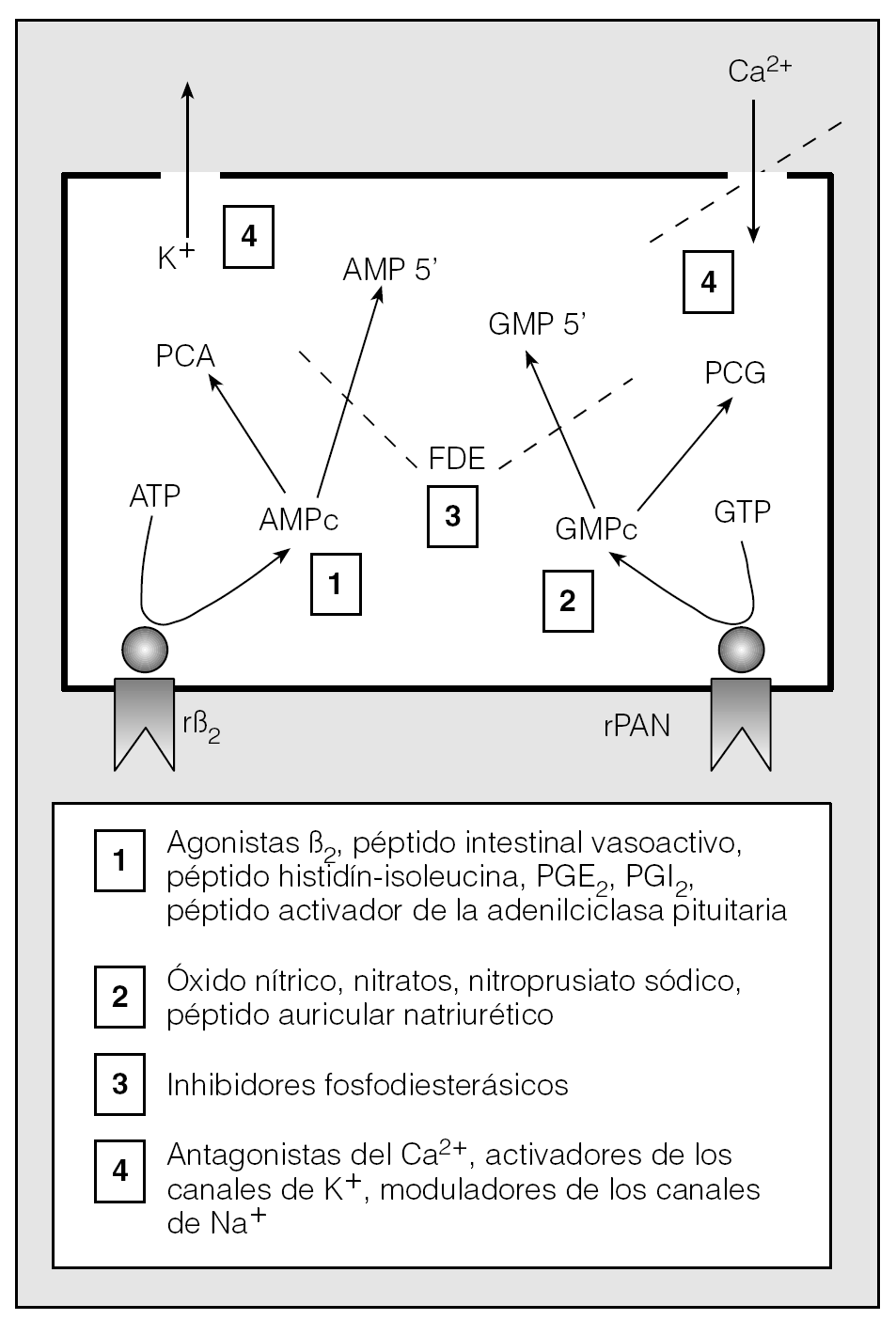
Los broncodilatadores se pueden clasificar en 2 grandes apartados en función del mecanismo farmacológico que determina su actividad relajadora: los antagonistas selectivos y los antagonistas funcionales16,17 (tabla I). Los primeros (broncodilatadores indirectos) bloquean el efecto de los mediadores contráctiles actuando directamente sobre sus receptores correspondientes o inhibiendo la síntesis y liberación del propio mediador16,17. El segundo grupo (broncodilatadores directos) engloba a todas las sustancias que disminuyen el tono del MLVA, sea cual sea la naturaleza del estímulo contracturante. La relajación se consigue reduciendo la [Ca2+]i o modificando la sensibilidad al Ca2+ de las proteínas contráctiles de diversos modos, que incluyen, entre otros, la activación del sistema mensajero de nucleótidos cíclicos (AMPc y GMPc), la inhibición de la degradación de dichos nucleótidos y la modulación de la actividad de los canales iónicos de la membrana celular (fig. 4). Una descripción pormenorizada de la génesis de la relajación en cada una de estas vías puede encontrarse en las excelentes revisiones realizadas por Thirstrup16, y Knox y Tattersfield18. Lo que sí nos interesa recordar ahora es que, para el MLVA, el AMPc representa la señal intracelular relajadora más importante y el adrenoceptor β2, su activador mejor estudiado18. Las características de ese tipo particular de receptores y las peculiaridades estructurales de sus agonistas selectivos (los simpatico-miméticos β2) han sido muy bien recogidas en la bibliografía, y conocemos con bastante precisión los mecanismos a través de los cuales la formación del complejo agonista-receptor se traduce en una disminución sustancial del tono del MLVA19,20-24 (fig. 5). Así las cosas, y como adelantábamos al principio, la atención de los expertos en este campo se ha venido focalizando durante los últimos años sobre un par de temas concretos. Uno de ellos hace referencia a los polimorfismos del adrenoceptor. El otro, todavía en fase muy experimental, tiene que ver con la aplicación de técnicas transgénicas para conseguir la sobreexpresión de los receptores β2 en el MLVA y otras células del pulmón.
Fig. 4. Principales vías de relajación en el músculo liso de la vía aérea (modificada de referencia 18). 1) Activación de los receptores ligados a AMPc. 2) Activación de receptores ligados a GMPc. 3) Inhibición de las fosfodiesterasas. 4) Modulación de canales iónicos (activación de los canales de K+ o inhibición de los canales de entrada de Ca2+). PCA: proteincinasa A; PCG: proteincinasa G; rβ2: receptor adrenérgico beta-2; rPAN: receptor para el péptido auricular natriurético.
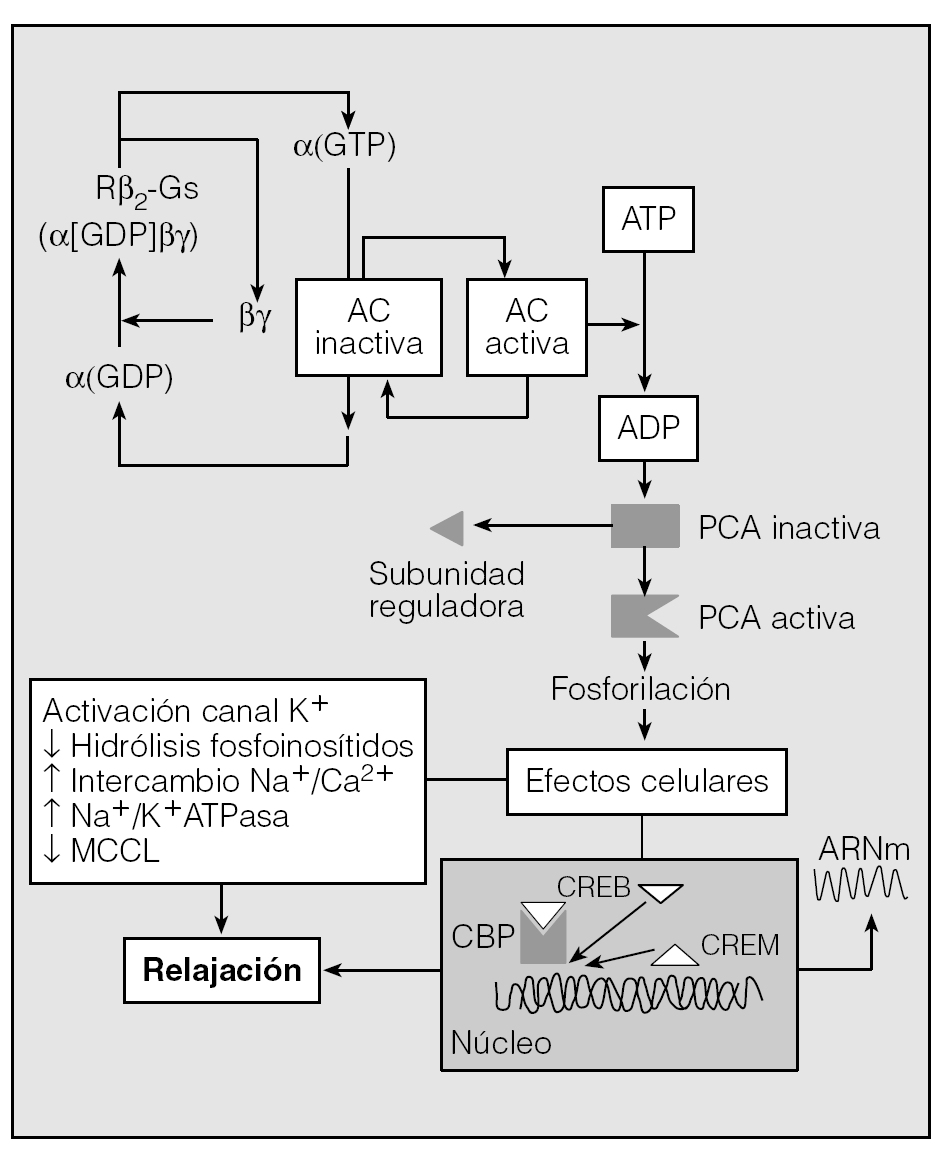
Fig. 5. Activación del receptor β2 por su agonista selectivo y mecanismos subsiguientes que provocan la relajación del MLVA. El receptor β2 se encuentra acoplado a la proteína reguladora Gs (fijadora de nucleótidos y con actividad GTPasa) constituida por tres subunidades (α, β y γ). En reposo, la subunidad α está ligada a GDP y asociada con β y γ. Cuando tiene lugar la formación del complejo agonista-receptor, se estimula el recambio GDP por GTP y son liberadas las subunidades α para fijarse a la adenilciclasa (AC) y estimularla. La AC activada cataliza ATP a AMPc que, a su vez, activa una proteincinasa A (PCA). La PCA fosforilará una serie de sustratos que determinarán la relajación a través de diversas vías1. Además, la activación de PCA provoca la inducción de diversos genes2 al fosforilar la proteína de unión de los elementos de respuesta AMPc (CREB) que actúa como factor de transcripción. CRE: elementos de respuesta AMPc; CBP: proteína de unión CREB; CREM: modulador CRE.
Polimorfismo de los receptores adrenérgicos β2
El receptor adrenérgico β2, cuyo gen se encuentra ubicado en el brazo largo del cromosoma 5, es una cadena polipeptídica de 413 aminoácidos (aproximadamente 46.500 Da), con 7 regiones hidrofóbicas inmersas en la membrana citoplásmica y 6 segmentos hidrofílicos en forma de bucle (3 extracelulares y 3 intracelulares)20,21. El sitio de unión para el agonista está localizado en un hueco delimitado por las regiones transmembrana III a VI. Allí, 2 residuos serina de la hélice V interactúan con los grupos hidroxilo 3 y 4 del anillo bencénico del agonista, y un residuo aspartato de la hélice III se combina con el grupo aminoterminal del mismo20,21. Hasta la fecha se han identificado 13 mutaciones o polimorfismos del adrenoceptor β2 y los más prevalentes entre los sujetos de raza blanca son: a) el cambio en la secuencia del aminoácido en la posición 16 (arginina [Arg] por glicina [Gli]); b) el cambio de glutamina (Gln) por ácido glutámico (Glu) en el codón 27, y c) treonina o isoleucina en la posición 16425-27. Los individuos con Arg/Arg en la posición 16 suelen tener Glu/Glu en la posición 27 y la presencia de Gli/Gli en 16 va acompañada habitualmente de Gln/Gln en 2728,29. Inicialmente se pensó que la variante Gli-16 estaba asociada con una mayor gravedad del asma y un aumento del grado de hiperrespuesta bronquial25,30,31, pero trabajos posteriores no lo han confirmado32. Lo que sí resulta cierto es que in vitro, la mutación Gli-16 del receptor favorece su regulación a la baja tras el contacto continuado con el simpaticomimético y la Arg-16 parece más resistente28.
Sin embargo, los estudios in vivo iniciales aportaron al respecto resultados contradictorios. En opinión de algunos, la desensibilización queda facilitada si Arg ocupa la posición 16, pero otros achacan el fenómeno a la existencia de Gli o a polimorfismos en 2733-36. La cuestión ha quedado bastante clarificada a partir de los trabajos de Israel et al37, y Taylor et al38. Los primeros demostraron que, en asmáticos leves y con Arg/Arg en la posición 16, el empleo regular de salbutamol durante 5 meses se asocia con una caída del flujo espiratorio máximo matutino y vespertino de unos 30 l/min. Esta circunstancia no se detectó en los pacientes que utilizaron el agonista β2 a demanda, o en los homocigóticos para Gli en el codón 16. Los polimorfismos del adrenoceptor en la posición 27 (Gln/Gln, Gln/Glu y Glu/Glu) tampoco influyeron en la evolución del flujo espiratorio máximo durante el período de seguimiento, así como tampoco en los tratados a demanda ni en los que tomaron el salbutamol de forma regular37. Por su parte, Taylor et al han comunicado igualmente que los enfermos con asma leve a moderada, homocigóticos para Arg en la posición 16 y tratados crónicamente con simpaticomiméticos β2 de acción corta, manifiestan una mayor susceptibilidad a presentar episodios de exacerbación que los heterocigóticos Arg/Gli o los homocigóticos (Gli/Gli). El genotipo de la posición 27 no modificó los resultados obtenidos38.
Para explicar esta evidente disparidad entre los hallazgos in vitro e in vivo, Liggett propone lo que se conoce como modelo dinámico de la cinética del receptor β2, que considera los efectos de las catecolaminas endógenas26. Según él, en condiciones basales, la variante Gli-16 (es decir, la forma del adrenoceptor más susceptible a la desensibilización, de acuerdo con los datos in vitro) estaría ya más regulada a la baja que la variante Arg-16 por el efecto previo de las catecolaminas naturales. Consecuentemente, la taquifilaxia evocada por el uso regular de agonistas β2 será mayor en los sujetos con adrenoceptores Arg-16, y la respuesta inicial provocada por la administración aguda de simpaticomiméticos quedará disminuida en los individuos con el polimorfismo Gli-1626,29,.
La enseñanza práctica de todo ello es que el uso regular de agonistas β2 de acción corta conlleva, a medio plazo y en un grupo de asmáticos genotípicamente caracterizados por la presencia de Arg/Arg en la posición 16 del receptor adrenérgico, efectos no deseados que dificultan el control de la enfermedad. Con la información actual, en puridad, la afirmación sólo es aplicable de momento al asma leve o moderada, pero cabe suponer que lo mismo sucede cuando la gravedad del proceso es mayor. Queda por definir si el fenómeno puede, asimismo, extrapolarse a los simpaticomiméticos β2 de larga duración.
Sobreexpresión de los receptores β2 en el MLVA
Una de las peculiaridades más interesantes de los receptores β2 es su capacidad para pasar de una conformación inactiva (R) a una conformación activa (R*), que estimula a su proteína G asociada incluso en ausencia de agonistas39. Esta activación espontánea es más fácilmente observable en el laboratorio utilizando células transfectadas (la transfección es un proceso por el que un gen o un fragmento de ADN foráneo es transferido o introducido en una célula). Con dicha tecnología se puede aumentar significativamente la expresión del receptor (sobreexpresión por transfección) y la cantidad de R* llega a ser suficiente para que, sin necesidad de simpaticomimético en el medio, aparezca una actividad mensurable de adenilciclasa40,41. Además, el aumento de R*, la conformación que facilita la unión con el agonista, incrementa la sensibilidad de este último para con su receptor41.
Bajo tales premisas, McGraw et al han analizado en ratas transgénicas (RT) las consecuencias de sobreexpresar los adrenoceptores β2, sirviéndose de un promotor (la actina α de músculo liso) que limita la sobreexpresión al MLVA42. En esas condiciones experimentales, los datos obtenidos demostraron que, basalmente, la densidad de receptores β2 presentes en el músculo liso traqueal de las RT fue muy superior (unas 75 veces) respecto a la detectada en los tejidos procedentes de animales control, con una actividad de la adenilciclasa y una producción de AMPc sustancialmente mayores. La sobreexpresión de los β2 también modificó la posición de las curvas dosis-respuesta al isoproterenol in vitro, desplazándolas hacia la izquierda, de manera que la dosis eficaz al 50% en los reactivos de las RT resultó ser 60 veces menor. Finalmente, los trabajos realizados in vivo por el grupo de McGraw pusieron de manifiesto que la metacolina inhalada provoca una broncoconstricción de magnitud inferior en los animales transgénicos y que, comparada con las ratas no manipuladas, el pretratamiento con albuterol reduce mucho más esa respuesta contráctil42.
En definitiva, lo que este y otros trabajos similares43,44 indican es que la solución para conseguir una mayor broncodilatación quizá sea actuar sobre el propio receptor y manipular su número y afinidad por el ligando, ya que es el receptor quien, de entrada, "limita" la transducción de las señales y el grado de relajación alcanzable por el MLVA41.
Sin duda alguna, los hechos que se acaban de resumir pertenecen al terreno del laboratorio pero, a nuestro entender, abren una serie de perspectivas apasionantes en el campo de la broncodilatación y permiten vislumbrar una era terapéutica radicalmente nueva. Los broncodilatadores del futuro seguramente incorporarán estos conocimientos que la medicina molecular y la biotecnología están ahora sacando a la luz. Sólo es cuestión de tiempo.