La Sociedad Española de Neumología y Cirugía Torácica (SEPAR), a través de las áreas de Cirugía Torácica y de Oncología Torácica, ha promovido la realización de un manual de recomendaciones para el diagnóstico y el tratamiento del cáncer de pulmón de células no pequeñas. Las elevadas incidencia y mortalidad de esta patología hacen necesaria una constante actualización de las mejores evidencias científicas para su consulta por parte de los profesionales de la salud.
Para su confección se ha contado con un amplio grupo de profesionales de distintas especialidades que han elaborado una revisión integral, que se ha concretado en 4 apartados principales. En el primero se ha estudiado la prevención y el cribado de la enfermedad, incluyendo los factores de riesgo, el papel de la deshabituación tabáquica y el diagnóstico precoz mediante programas de cribado. En un segundo apartado se ha analizado la presentación clínica, los estudios de imagen y el riesgo quirúrgico, incluyendo el cardiológico y la evaluación funcional respiratoria. Un tercero trata sobre los estudios de confirmación cito-histológica y de estadificación, con un análisis de las clasificaciones TNM e histológica, métodos no invasivos y mínimamente invasivos, así como las técnicas quirúrgicas para el diagnóstico y estadificación. En un cuarto y último capítulo se han abordado aspectos del tratamiento, como el papel de las técnicas quirúrgicas, la quimioterapia, la radioterapia, el abordaje multidisciplinar por estadios y otros tratamientos dirigidos frente a dianas específicas, terminando con recomendaciones acerca del seguimiento del cáncer de pulmón y los tratamientos paliativos quirúrgicos y endoscópicos en estadios avanzados.
The Thoracic Surgery and Thoracic Oncology groups of the Spanish Society of Pulmonology and Thoracic Surgery (SEPAR) have backed the publication of a handbook on recommendations for the diagnosis and treatment of non-small cell lung cancer. Due to the high incidence and mortality of this disease, the best scientific evidence must be constantly updated and made available for consultation by healthcare professionals.
To draw up these recommendations, we called on a wide-ranging group of experts from the different specialties, who have prepared a comprehensive review, divided into 4 main sections. The first addresses disease prevention and screening, including risk factors, the role of smoking cessation, and screening programs for early diagnosis. The second section analyzes clinical presentation, imaging studies, and surgical risk, including cardiological risk and the evaluation of respiratory function. The third section addresses cytohistological confirmation and staging studies, and scrutinizes the TNM and histological classifications, non-invasive and minimally invasive sampling methods, and surgical techniques for diagnosis and staging. The fourth and final section looks at different therapeutic aspects, such as the role of surgery, chemotherapy, radiation therapy, a multidisciplinary approach according to disease stage, and other specifically targeted treatments, concluding with recommendations on the follow-up of lung cancer patients and surgical and endoscopic palliative interventions in advanced stages.
La Sociedad Española de Neumología y Cirugía Torácica (SEPAR) promueve la elaboración del presente documento con el objeto de proporcionar recomendaciones para la práctica clínica, basadas en las mejores evidencias disponibles, en el proceso de diagnóstico y tratamiento de los pacientes afectados por cáncer de pulmón de células no pequeñas (CPCNP). La gravedad relacionada con la incidencia y el pronóstico del cáncer de pulmón (CP)1, la complejidad de las técnicas diagnósticas y la mayor disponibilidad de tratamientos hacen necesaria una constante actualización de los procesos de práctica clínica en esta enfermedad.
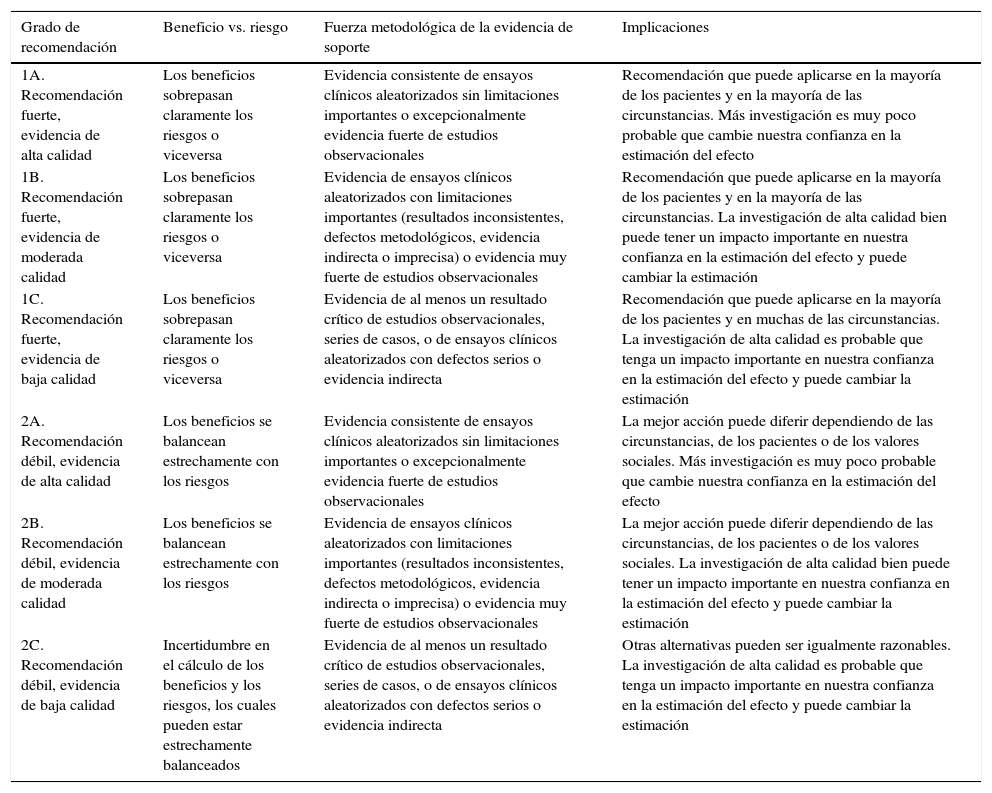
En la elaboración de este documento se ha llevado a cabo una búsqueda, evaluación y síntesis de la literatura actual sobre cada uno de los puntos a discutir, a través de distintas bases de datos. Para la formulación de recomendaciones se ha utilizado el grado de recomendación según el American College of Chest Physicians-ACCP Grading System (tabla 1)2.
Grados de recomendación según el American College of Chest Physicians-ACCP Grading System
| Grado de recomendación | Beneficio vs. riesgo | Fuerza metodológica de la evidencia de soporte | Implicaciones |
|---|---|---|---|
| 1A. Recomendación fuerte, evidencia de alta calidad | Los beneficios sobrepasan claramente los riesgos o viceversa | Evidencia consistente de ensayos clínicos aleatorizados sin limitaciones importantes o excepcionalmente evidencia fuerte de estudios observacionales | Recomendación que puede aplicarse en la mayoría de los pacientes y en la mayoría de las circunstancias. Más investigación es muy poco probable que cambie nuestra confianza en la estimación del efecto |
| 1B. Recomendación fuerte, evidencia de moderada calidad | Los beneficios sobrepasan claramente los riesgos o viceversa | Evidencia de ensayos clínicos aleatorizados con limitaciones importantes (resultados inconsistentes, defectos metodológicos, evidencia indirecta o imprecisa) o evidencia muy fuerte de estudios observacionales | Recomendación que puede aplicarse en la mayoría de los pacientes y en la mayoría de las circunstancias. La investigación de alta calidad bien puede tener un impacto importante en nuestra confianza en la estimación del efecto y puede cambiar la estimación |
| 1C. Recomendación fuerte, evidencia de baja calidad | Los beneficios sobrepasan claramente los riesgos o viceversa | Evidencia de al menos un resultado crítico de estudios observacionales, series de casos, o de ensayos clínicos aleatorizados con defectos serios o evidencia indirecta | Recomendación que puede aplicarse en la mayoría de los pacientes y en muchas de las circunstancias. La investigación de alta calidad es probable que tenga un impacto importante en nuestra confianza en la estimación del efecto y puede cambiar la estimación |
| 2A. Recomendación débil, evidencia de alta calidad | Los beneficios se balancean estrechamente con los riesgos | Evidencia consistente de ensayos clínicos aleatorizados sin limitaciones importantes o excepcionalmente evidencia fuerte de estudios observacionales | La mejor acción puede diferir dependiendo de las circunstancias, de los pacientes o de los valores sociales. Más investigación es muy poco probable que cambie nuestra confianza en la estimación del efecto |
| 2B. Recomendación débil, evidencia de moderada calidad | Los beneficios se balancean estrechamente con los riesgos | Evidencia de ensayos clínicos aleatorizados con limitaciones importantes (resultados inconsistentes, defectos metodológicos, evidencia indirecta o imprecisa) o evidencia muy fuerte de estudios observacionales | La mejor acción puede diferir dependiendo de las circunstancias, de los pacientes o de los valores sociales. La investigación de alta calidad bien puede tener un impacto importante en nuestra confianza en la estimación del efecto y puede cambiar la estimación |
| 2C. Recomendación débil, evidencia de baja calidad | Incertidumbre en el cálculo de los beneficios y los riesgos, los cuales pueden estar estrechamente balanceados | Evidencia de al menos un resultado crítico de estudios observacionales, series de casos, o de ensayos clínicos aleatorizados con defectos serios o evidencia indirecta | Otras alternativas pueden ser igualmente razonables. La investigación de alta calidad es probable que tenga un impacto importante en nuestra confianza en la estimación del efecto y puede cambiar la estimación |
Modificado de Lewis et al.2.
El humo del cigarrillo es el principal agente causal del CP (90% de los casos). Sin embargo, se ha identificado la existencia de otros factores que pueden actuar sinérgicamente con el humo del cigarrillo y modificar la prevalencia del CP, como son3: dieta, actividad física, exposiciones ocupacionales, tanto ambientales domésticos como industriales, radiaciones, polución ambiental, factores relacionados con el huésped, existencia de una enfermedad pulmonar adquirida como la enfermedad pulmonar obstructiva crónica (EPOC) y las enfermedades fibróticas.
La EPOC es un factor de riesgo independiente para el desarrollo de CP, siendo en el fenotipo enfisematoso donde la incidencia de CP está elevada4,5 (grado 1A). Los eventos moleculares y celulares de inflamación6 y estrés oxidativo locales contribuyen a la patogenia del CP en pacientes con enfermedades crónicas respiratorias (grado 1A), mientras que el estrés oxidativo sistémico es un potencial valor predictivo de desarrollo de CP en pacientes con EPOC7 (grado 1B).
Deshabituación tabáquicaLa terapia farmacológica de primera línea (terapia sustitutiva con nicotina, bupropión y vareniclina), en monoterapia o de forma combinada, y asociada al asesoramiento psicológico, ha demostrado ser coste-efectiva y se debe proporcionar a todos los fumadores8,9 (grado 1A).
En los programas de cribado del CP con tomografía computarizada (TC) de baja dosis se recomienda proporcionar consejo para dejar de fumar, asociado a farmacoterapia10 (grado 1B).
Otro aspecto relevante es cómo afrontar el tabaquismo en pacientes con CP que van a recibir tratamiento. Para mejorar las tasas de abandono en aquellos que van a ser sometidos a cirugía se puede recomendar el uso de terapia farmacológica10 (grado 1B). El empleo de la quimioterapia (QT) puede dificultar el enfoque del abandono del tabaquismo. En estos casos se recomienda tanto el consejo como la terapia farmacológica, a fin de mejorar las tasas de abandono (grado 1B) y el bupropión en enfermos con síntomas depresivos11 (grado 2B). En los sujetos sometidos a radioterapia (RT) también recomendamos consejo más farmacoterapia12 (grado 1B).
CribadoDiferentes estudios aleatorizados han intentado relacionar la realización de una radiografía de tórax anual con la reducción de la mortalidad13,14. Sin embargo, los resultados de estos demuestran que esta no reduce la mortalidad por CP y, por tanto, no es recomendable como herramienta de cribado (grado 1A).
Los datos del National Lung Screening Trial (NLST)15, junto con la evidencia aportada por otros estudios de asignación aleatoria, suponen un claro cambio de tendencia en el cribado del CP con TC de baja dosis de radiación15,16. La definición de alto riesgo no está claramente establecida, pero el NLST utilizó los siguientes criterios de inclusión: edad entre 55 y 74 años, al menos 30 paquetes-año de tabaquismo y un máximo período de abstinencia tabáquica de 15 años (grado 1B). El hallazgo más significativo en el grupo de cribado con el TC de baja dosis fue una reducción en la mortalidad por CP de un 20% (grado 1B). Además, varios estudios también han demostrado la importancia del enfisema como factor de riesgo que permite optimizar la selección de sujetos y, por ende, reducir costes, falsos positivos y la ansiedad atribuibles al cribado4,17,18.
Según el International Early Lung Cancer Action Program (iELCAP), el uso de un protocolo para la evaluación y el seguimiento del nódulo pulmonar (NP), detectado por cribado con TC, garantiza que más de un 90% de las biopsias realizadas serán diagnósticas de un CP19. Por tanto, en los programas de cribado es aconsejable utilizar protocolos de seguimiento basados en técnicas de imagen, con la intención de reducir la tasa de falsos positivos y evitar biopsias innecesarias (grado 1B). El riesgo de morbimortalidad por procedimientos invasivos para el diagnóstico de hallazgos positivos en las TC de cribado es muy bajo (grado 1B).
El riesgo de la radiación recibida con motivo del cribado es, probablemente, también muy bajo. No existen estudios fiables al respecto, siendo difícil predecir el riesgo para una dosis de radiación por debajo de los 50-100 mSv, pudiendo ser inexistente20 (grado 2C).
Presentación clínica. Estudios de imagen y analíticos. Riesgo quirúrgico y evaluación funcionalDiagnóstico clínico. Marcadores séricosLa sospecha clínica se basa en la historia clínica y en la capacidad de reconocer signos y síntomas propios pero, en ocasiones, poco específicos de la enfermedad. La edad, el consumo de tabaco, la historia familiar de CP y de la esfera orofaríngea y la exposición al asbesto incrementan el riesgo de CP21,22. Ante la sospecha clínica, el paciente debe remitirse de forma rápida al especialista, ser incluido en un circuito de diagnóstico rápido y valorado por un equipo multidisciplinar (grado 2C).
El papel de los marcadores séricos en la detección precoz y diagnóstico del CP no está probado y no existen recomendaciones claras respecto a su determinación y utilidad en la práctica clínica. Esto es debido, sobre todo, a su baja sensibilidad y a la falta de especificidad de marcadores exclusivos de neoplasias pulmonares. Diversos estudios han puesto de manifiesto que en la evaluación inicial los marcadores tumorales séricos, particularmente el CEA y CYFRA 21-1, pueden ser de ayuda en el diagnóstico y en la estimación del pronóstico23,24 (grado 2C).
Técnicas de imagenLa radiografía de tórax sigue siendo la técnica de imagen más utilizada para descartar un posible CP y estudiar el efecto de determinados tratamientos25. Ante un NP indeterminado en una radiografía y/o TC, se recomienda la revisión de todo su historial de pruebas de imagen (grado 1C). En caso de que dicho nódulo sea diagnosticado por radiografía se recomienda realizar una TC para ayudar en la caracterización de la lesión26,27 (grado 1C).
La TC es la prueba de referencia en el diagnóstico y la estadificación del CP, siendo obligada su realización ante lesiones sospechosas de malignidad en la radiografía26,27. Cuando se detecta un NP solitario existen parámetros clínicos y radiológicos (tamaño, forma, densidad y velocidad de crecimiento) relacionados con una mayor probabilidad de malignidad28. En caso de un NP sólido que ha permanecido estable durante al menos 2 años, se recomienda no prolongar el seguimiento (grado 2C). Una importante clasificación es la que categoriza al NP en sólido, no sólido y parcialmente sólido29, siendo de particular interés las lesiones no sólidas que evolucionan hacia un patrón parcialmente sólido, hecho que puede indicar el desarrollo de un componente maligno.
El uso combinado de la TC con la tomografía por emisión de positrones (PET) representa una importante herramienta en el diagnóstico y el tratamiento del CP, así como una aproximación a la caracterización del NP29. En el estadio clínico IA con tumor periférico con PET-TC sin ganglios de tamaño aumentado ni captación ganglionar mediastínica, no es necesaria la estadificación clínica invasiva (grado 2B). En cambio, en pacientes con ganglios aumentados de tamaño, sin metástasis a distancia con o sin captación en la PET-TC, y en aquellos con ganglios de tamaño normal, sin metástasis a distancia pero que muestren captación en la PET-TC, se recomienda la estadificación invasiva30,31 (grado 1C).
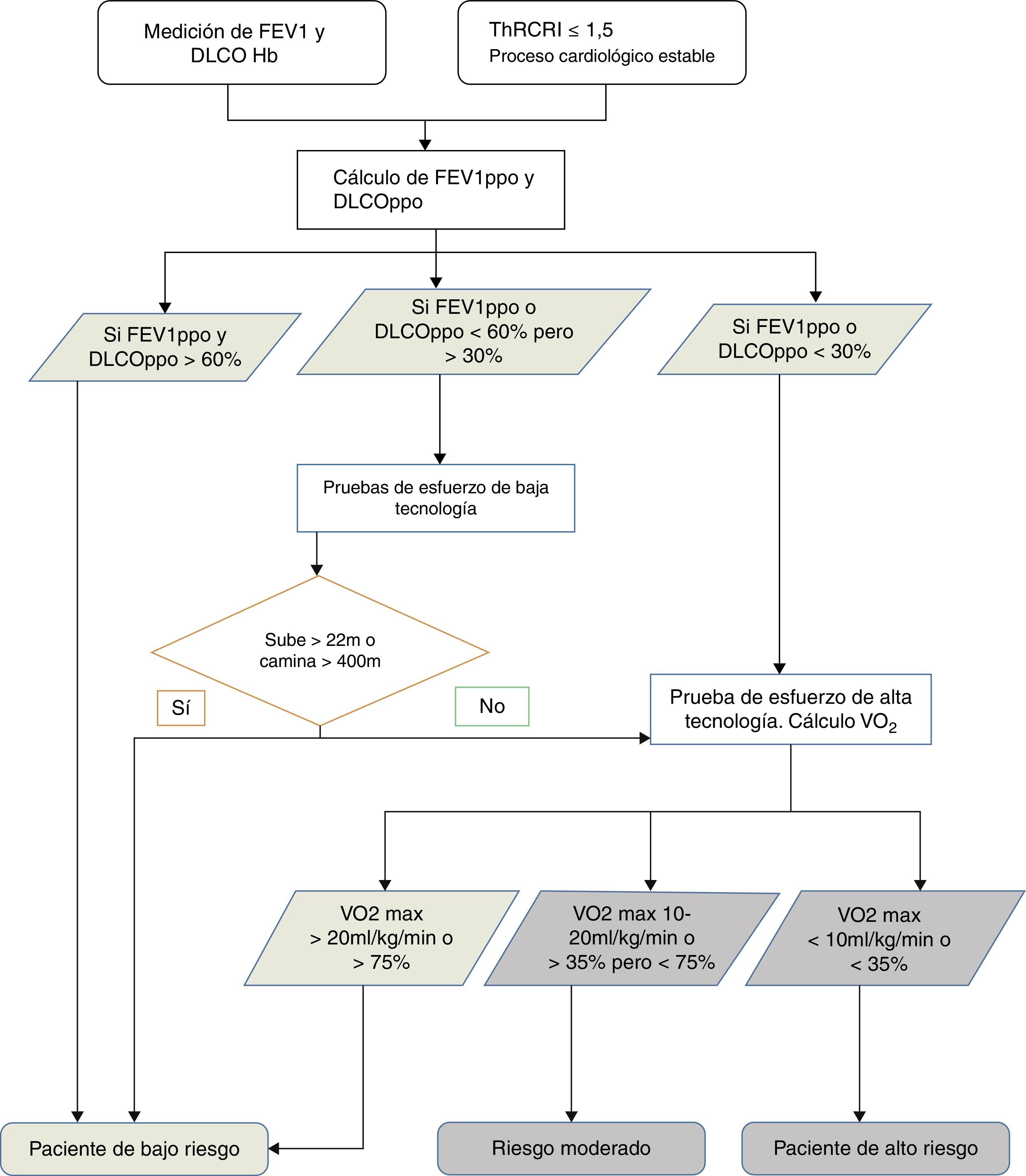
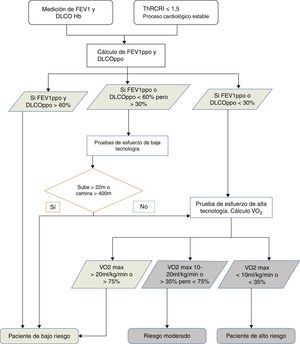
Evaluación preoperatoria del riesgo quirúrgicoSiguiendo las guías publicadas32,33, el primer escalón en la evaluación preoperatoria es la cuantificación del riesgo cardiovascular. Después se analizará la función pulmonar y a continuación, si es preciso, la capacidad de esfuerzo aeróbico (fig. 1).
Algoritmo de decisión para la clasificación del riesgo quirúrgico. FEV1: volumen espiratorio forzado en el primer segundo; DLCO: capacidad de difusión del CO; Hb: hemoglobina; ThRCRI: Thoracic Revised Cardiac Risk Index; ppo: previsto postoperatorio; VO2: consumo de oxígeno; max: máximo.
En la evaluación cardiológica debe utilizarse el Thoracic Revised Cardiac Risk Index (ThRCRI)34,35. Todo paciente con una situación cardiológica estable y un ThRCRI ≤1,5 puede ser intervenido sin necesitar una evaluación cardiológica específica35 (grado 1C). Además, se debe evitar la resección pulmonar en enfermos con infarto agudo de miocardio reciente, dentro de los 30 días siguientes (grado 1B).
En este momento existen datos suficientes32,33 que apoyan la medición del volumen espiratorio forzado en el primer segundo (FEV1) y la capacidad de difusión del CO (DLCO) a todo paciente con CP al que se evalúa para una resección pulmonar (grado 1B). Si el cálculo de FEV1 y DLCO previstos postoperatorios (ppo) es mayor que el 60%, no son necesarios más estudios (grado 1C). Si están por debajo del 60% pero son superiores al 30% se recomienda evaluar la capacidad de ejercicio aeróbico con una prueba de baja tecnología, como la de subir escaleras limitada por síntomas o el Shuttle Walking Test (grado 1C), en donde si, respectivamente, un sujeto no alcanza los 22m de altura36 o no llega a recorrer 400m, debe ser remitido para realizar una prueba de ejercicio cardiopulmonar con medición directa del consumo de oxígeno (grado 1C). En cambio, si fueran inferiores al 30%, debe ser remitido directamente para la realización de la prueba de ejercicio cardiopulmonar de alta tecnología32 (grado 1B), donde si el consumo de oxígeno medido es inferior a 10ml/kg/min o al 35%32 se recomienda no realizar una resección anatómica, y que se utilice un abordaje mínimamente invasivo o se realice un tratamiento no quirúrgico (grado 1C).
Estudios de confirmación cito-histológica y estadificaciónEstadiosLa clasificación TNM tiene indudable valor pronóstico y es de importancia crítica para orientar la elección del mejor tratamiento posible37. Sin embargo, el grado de extensión no dicta, sin más, el tratamiento a aplicar. Este depende también de los rasgos histológicos del tumor y de circunstancias clinicofuncionales del paciente38. Por tanto, en enfermos con sospecha o diagnóstico confirmado de CP se recomienda efectuar una cuidadosa evaluación clínica que permita establecer un estadio TNM inicial39 (grado 1B).
Junto a la consistencia de esta clasificación, tal vez la ventaja más destacable sea la universalización de la misma, tanto en un sentido geográfico, terapéutico e histológico40–42. Además, la agrupación de estadios es más acorde con las posibilidades quirúrgicas.
Clasificación y estudio anatomopatológicoEl diagnóstico anatomopatológico de los CP debe hacerse de acuerdo con la clasificación de la World Health Organization y de la International Association for the Study of Lung Cancer (IASLC) del adenocarcinoma43,44. Concretar el subtipo específico de todos los CPCNP es imprescindible para una decisión terapéutica y para reducir al máximo los CPCNP no especificados de otro modo. En el CPNCP se recomienda la diferenciación entre adenocarcinoma y carcinoma de células escamosas, incluso en biopsias de pequeño tamaño o material de citología45 (grado 1B). Además, ante tumores glandulares (adenocarcinomas) se recomienda distinguir los adenocarcinomas in situ y los mínimamente invasivos de los invasivos45 (grado 1C).
Actualmente, se debe realizar la determinación de las mutaciones en el gen EGFR y los reordenamientos de ALK en todos los pacientes con CPCNP, no escamoso, en estadio IV, independientemente del hábito tabáquico y en todos los pacientes no fumadores, independientemente de la histología del tumor46,47.
Métodos no invasivosEl análisis de la citología del esputo tiene las ventajas de ser económico, sencillo y de recoger material del aparato respiratorio de forma no invasiva48. La calidad del esputo y la preservación son muy importantes para obtener un resultado certero, recomendándose la recogida de al menos 3 muestras en días diferentes. En cambio, tiene una sensibilidad variable dependiendo de las condiciones de recogida, procesado y características del tumor49,50. Un resultado negativo debe continuarse con otras pruebas diagnósticas invasivas (grado 1C).
Técnicas mínimamente invasivasEl desarrollo de nuevas técnicas en intervencionismo broncoscópico ha conseguido que se pueda acceder incluso a lesiones en la periferia pulmonar51 y a metástasis linfáticas mediastínicas52. Ante la sospecha de CP con afectación mediastínica por técnicas de imagen y sin evidencia de enfermedad metastásica extratorácica (PET negativa), se recomienda establecer el diagnóstico de CP con el método menos invasivo y más seguro: broncoscopia convencional con punción transbronquial ciega (PTB), ecografía endobronquial (EBUS) con punción aspirativa con aguja fina (PAAF), ecografía endoscópica digestiva (EUS) con PTB, punción transtorácica o mediastinoscopia (grado 1C).
La PTB permite la obtención de muestras citológicas e histológicas de ganglios hiliares y mediastínicos. Su rentabilidad diagnóstica inferior a la de la EBUS53, pero aumenta si se combina con EBUS o EUS54.
La PAAF es una técnica que combinada con EBUS/EUS permite la evaluación y estadificación de ganglios linfáticos mediastínicos55 y reduce la necesidad de mediastinoscopia o toracotomía (métodos más agresivos y costosos).
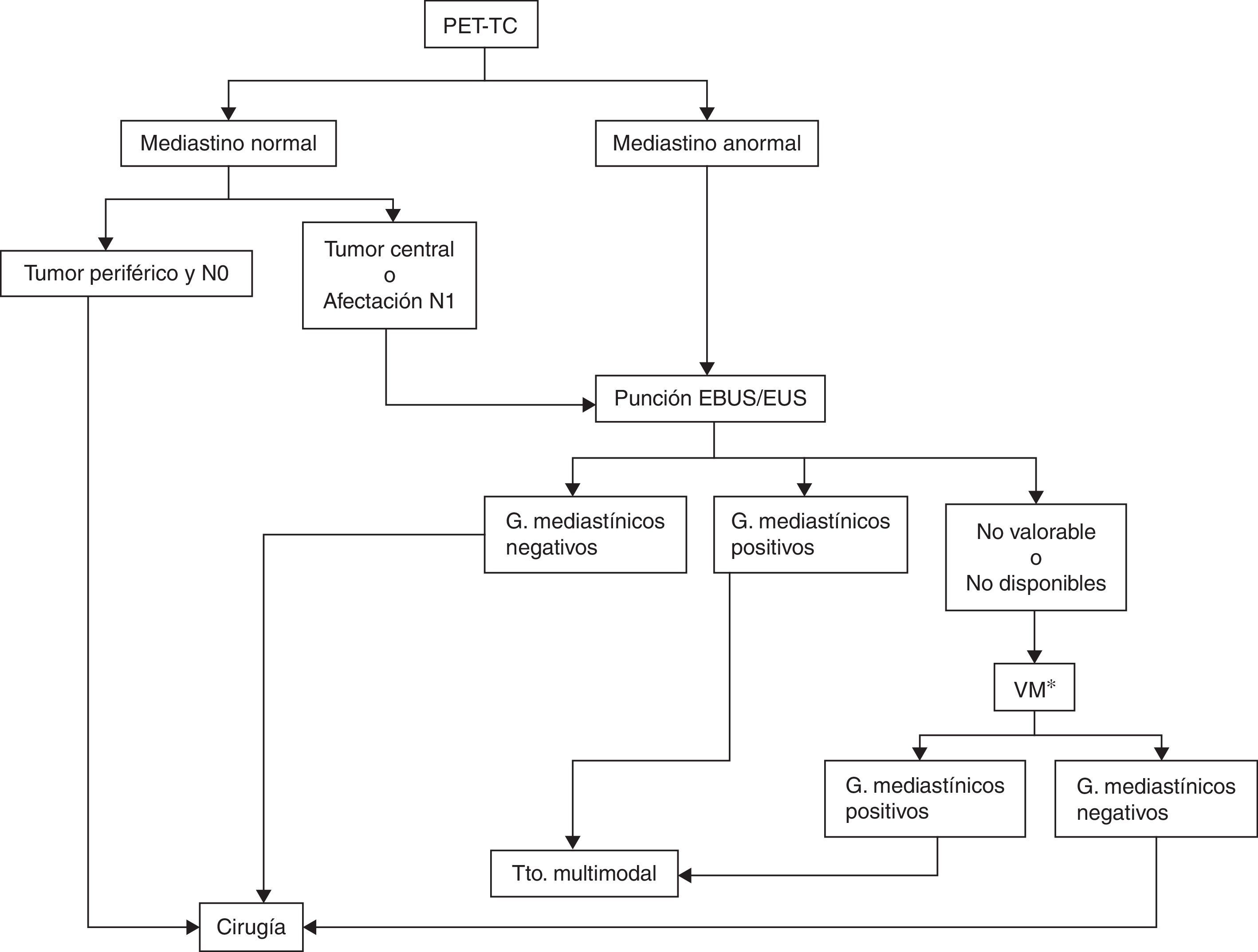
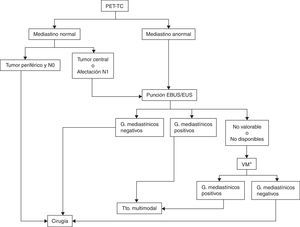
La evaluación de las muestras de las adenopatías hiliares y mediastínicas realizada en tiempo real por ecografía, ya sea endobronquial o endoscópica, hace más precisa la estadificación. La EBUS es superior a la estadificación quirúrgica en pacientes con alta sospecha de afectación tumoral mediastínica56,57 (grado 1C). La combinación EBUS/EUS tiene también una mayor rentabilidad al permitir la obtención de muestras tanto de lesiones pulmonares como de adenopatías mediastínicas58,59 (grado 1C). En pacientes sin metástasis a distancia y con alta sospecha de N2-N3, ya sea por TC o por PET, se recomienda realizar EUS, EBUS o la combinación de ambas56 (grado 1B) (fig. 2).
Algoritmo de estadificación ganglionar del mediastino.
EBUS/EUS no valorable: se considera que una muestra de EBUS no es valorable cuando no hay linfocitos y únicamente contiene células sanguíneas, bronquiales o fibrosis sin poderse confirmar que se trata de una punción ganglionar. En el caso de aparecer células tumorales sin linfocitos se considera muestra adecuada. Aunque no se pueda demostrar su origen ganglionar por anatomía patológica, se presupone por la confirmación ecográfica de la punción.
G: ganglios; Tto.: tratamiento; VM: videomediastinoscopia.
* Aquí también se incluye la realización de otras técnicas quirúrgicas, como la mediastinoscopia cervical extendida, la mediastinotomía anterior o la videotoracoscopia cuando los ganglios sospechosos no son accesibles por videomediastinoscopia, como ocurre con las estaciones ganglionares 5 y 6 en los carcinomas del lóbulo superior izquierdo.
La EBUS radial se recomienda como modalidad diagnóstica en pacientes con un NP periférico sospechoso de malignidad no candidatos a cirugía (grado 1C). En la detección de tumores centrales intratorácicos, su precisión (75%) es superior a la de la TC (51%). También permite diferenciar entre infiltración tumoral de la pared y compresión extrínseca sin invasión de la misma60.
La broncoscopia por navegación electromagnética se recomienda en pacientes con lesiones pulmonares periféricas de difícil acceso con la broncoscopia convencional61 (grado 1C). Además, permite obtener muestras de ganglios linfáticos mediastínicos.
Técnicas quirúrgicasHasta hace unos años, la mediastinoscopia era la técnica de elección para la estadificación del mediastino. Sin embargo, la generalización de la PET-TC como método de estadificación en el CP y la reciente incorporación de las punciones ganglionares por EBUS y EUS han conducido a una reducción de las indicaciones de la mediastinoscopia62, dejando de ocupar el primer escalón de sus algoritmos de estadificación mediastínica30,31,63 (fig. 2).
En los pacientes con CPCNP del lóbulo superior izquierdo y ganglios de las estaciones 5 y/o 6 positivos por PET-TC está indicada la biopsia quirúrgica de los mismos (por mediastinotomía anterior, mediastinoscopia cervical extendida o videotoracoscopia) cuando el resto de las estaciones ganglionares mediastínicas no se encuentran afectadas31,64 (grado 2B), ya que ante la presencia de ganglios con captación patológica en otras estaciones está indicada la biopsia de los mismos por EBUS/EUS o mediastinoscopia31.
En comparación con la mediastinoscopia, la videotoracoscopia permite valorar la cavidad pleural y el pulmón, y el acceso a las estaciones ganglionares mediastínicas inferiores65. La videotoracoscopia también es útil en el diagnóstico y el tratamiento del NP periférico66.
TratamientoCirugíaEn estadios I y II del CPCNP la cirugía radical ofrece la mejor posibilidad de curación (grado 1B), siendo menor la supervivencia cuanto más alto es el estadio67,68. En pacientes con estadio IIIA y afectación N2 discreta, identificada preoperatoriamente, el tratamiento quirúrgico como primera opción terapéutica no es válido fuera de ensayos clínicos (grado 1C). No obstante, dentro de un esquema terapéutico multidisciplinar, puede ser útil en pacientes bien seleccionados, tras terapia de inducción y con valoración posterior con enfermedad residual resecable (grado 1A), ya que ofrece mayor supervivencia a largo plazo respecto a otros tratamientos69. Tras terapia de inducción se evitará la neumonectomía, sobre todo la derecha70,71, dada su alta mortalidad postoperatoria, salvo en centros con gran experiencia (grado 2C), donde la mortalidad es casi similar a la no precedida por inducción72. En caso de enfermedad mediastínica oculta, la resección del tumor y las adenopatías está indicada si esta puede ser completa (grado 2C).
En el estadio IIIA por T3N1 se recomienda la cirugía en pacientes con CPCNP potencialmente resecables y dentro de un esquema terapéutico multidisciplinar (grado 1B). En aquellos con afectación de pleura parietal se debería realizar su resección en bloque73 (grado 2C). En tumores del vértice pulmonar se aconseja que la cirugía con parieto-lobectomía en bloque sea precedida de terapia de inducción (grado 2B), ofreciendo también mayor supervivencia74,75.
Dentro de un esquema terapéutico multidisciplinar se recomienda la cirugía en el CPCNP con afectación T4 por nódulos tumorales ipsolaterales en diferentes lóbulos (grado 1B), con cifras de supervivencia cercanas al 15% a 5 años75, y en el CPCNP potencialmente resecable, sin afectación mediastínica y con metástasis suprarrenal o cerebral erradicable76,77 (grado 1C).
Respecto a la linfadenectomía mediastínica, se recomienda la disección ganglionar sistemática, para mejorar la precisión de la estadificación y, eventualmente, aumentar la supervivencia y el intervalo libre de enfermedad75,78 (grado 2C).
En las resecciones incompletas puede haber una ventaja en supervivencia cuando el residuo es microscópico o adenopático, pero no cuando es macroscópico79 (grado 1C).
Si valoramos la técnica quirúrgica, la resección pulmonar anatómica mediante toracoscopia es preferible, cuando sea factible, a la abierta (grado 2B), disminuyendo la morbimortalidad y la estancia hospitalaria80,81. Si lo que analizamos es el tipo de resección, concluimos que:
- a.
En pacientes de alto riesgo de mortalidad operatoria con CPCNP en estadio I y tumores de hasta 2cm la segmentectomía anatómica o la resección en cuña, con márgenes negativos, son preferibles a la lobectomía82 (grado 2C). Esta última es la técnica de elección en los estadios I y II83,84 (grado 1B).
- b.
Se efectuará neumonectomía solo cuando el CPCNP no pueda ser resecado de forma completa mediante lobectomía, incluyendo técnicas broncoangioplásticas85 (grado 1B).
- c.
En pacientes con T4N0-1, cuidadosamente seleccionados, está indicada la cirugía en el contexto de un tratamiento multidisciplinar86 (grado 2B).
El tratamiento del CPCNP está en constante evolución y actualmente la mayoría de enfermos son subsidiarios de manejo multimodal, siendo la QT parte esencial del mismo87,88. Así, en pacientes intervenidos con estadio II o III se recomienda QT postoperatoria o adyuvante siempre que la resección haya sido completa. Si es incompleta, se recomienda QT y RT.
Tradicionalmente se ha asociado el estadio IIIA con un manejo de QT neoadyuvante seguido de cirugía y el estadio IIIB con un manejo de quimiorradioterapia (QT/RT) de forma secuencial o concurrente. Sin embargo, los límites son cada vez más imprecisos existiendo datos que avalan el papel de la cirugía en subgrupos de pacientes con estadio IIIB, así como de la QT/RT concurrente previa a la cirugía en estadio IIIA89,90.
En el estadio III resecable el tratamiento combinado con QT adyuvante y cirugía supone un beneficio frente a otros tratamientos (grado 1A). La tasa de respuestas objetivas esperable con un esquema de QT de 2 fármacos y que incluya cisplatino está alrededor del 60-70%. En cambio, no se ha encontrado beneficio en la supervivencia al asociar RT a la QT preoperatoria en pacientes N2 potencialmente resecables90. En el estadio IIIB y buen estado general (ECOG 0-1) se recomienda tratamiento combinado de QT y RT89 (grado 1A).
En los pacientes con CPCNP estadio IV, buen estado general (ECOG 0-1) y no subsidiarios de tratamiento dirigido, la recomendación actual es utilizar una combinación de 2 fármacos basada en platino (grado 1A), puesto que prolonga la supervivencia y mejora la calidad de vida88,89. La QT debe iniciarse en cuanto se haya establecido el diagnóstico y no está recomendado más de 4-6 ciclos de QT de primera línea (grado 2B). En ausencia de alteración molecular, la histología es un factor determinante para la elección del tratamiento (grado 1A), obteniéndose mejores resultados con cisplatino-pemetrexed en los tumores no escamosos. Así mismo, bevacizumab asociado a QT solo se recomienda en el carcinoma no escamoso, donde la toxicidad es inferior a la observada en los pacientes con tumores escamosos91,92.
En el CPCNP avanzado que no haya progresado después de la primera línea, el tratamiento de mantenimiento ha demostrado mejorar la supervivencia93,94 (grado 1A). Tras completar una primera línea, el paciente continuará con monoterapia hasta la progresión o presencia de toxicidad.
La QT de segunda línea ha demostrado beneficio en supervivencia y control de síntomas en el CPCNP avanzado y ECOG 0-2, independientemente de la histología95 (grado 1A). Se recomienda la monoterapia en el tratamiento de segunda línea (grado 1A) y continuarla hasta la progresión.
Las mutaciones de EGFR y las translocaciones de ALK se utilizan actualmente como factores predictivos de eficacia terapéutica en el CPCNP avanzado, de forma que quienes las presentan reciben tratamientos dirigidos en forma de inhibidores de la tirosin cinasa96 e inhibidores de ALK97, respectivamente.
En estadios I y II está indicada la RT estereotáxica hipofraccionada (SBRT) en enfermos inoperables, de elevado riesgo quirúrgico o que rechazan cirugía y tengan estadio I (T1, o T2 ≤ 5cm), localizados a más de 2cm del árbol bronquial principal y al menos a 1,5cm de la aorta y la arteria pulmonar principal98. La RT convencional está indicada en pacientes no operables que no reúnan criterios para tratamiento con SBRT y la RT postoperatoria no está indicada, excepto si existe margen afectado. En estos casos puede realizarse QT/RT concurrente. En el estadio III potencialmente resecable la RT puede formar parte del tratamiento, tanto preoperatoria junto a la QT (siendo de primera elección en tumores de sulcus superior)74 como postoperatoria. En el estadio III irresecable el tratamiento estándar es la QT/RT concurrente99. En el estadio IV la RT está indicada para paliación de síntomas, tanto locorregional como en metástasis cerebrales y/u óseas.
Tratamiento inicial por estadiosDada la cada vez más frecuente aplicación de tratamientos multidisciplinares, recopilamos y englobamos los aspectos fundamentales del tratamiento inicial en los distintos estadios clínicos (tabla 2). Su información se cumplimenta con los apartados anteriores para una más completa explicación de las características de los tratamientos y las evidencias disponibles.
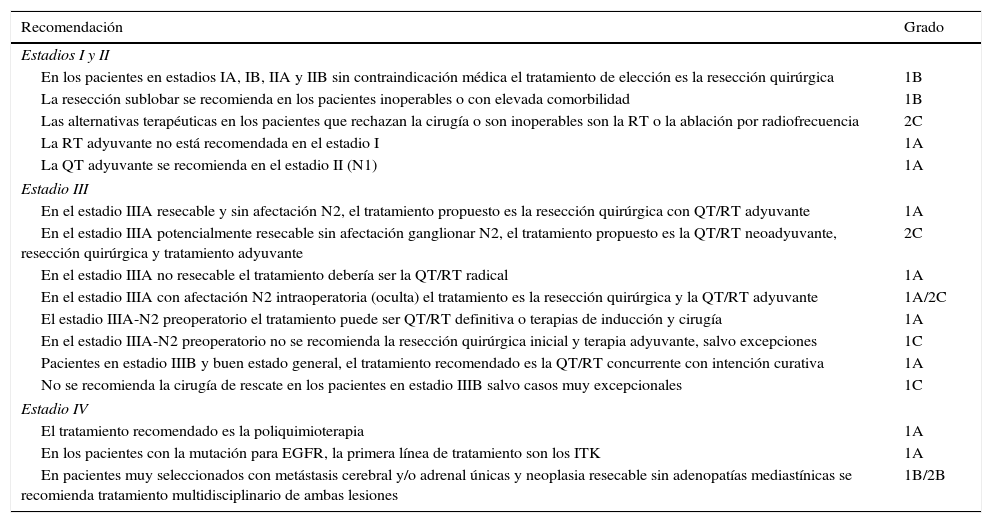
Resumen de recomendaciones de tratamiento según el estadio clínico
| Recomendación | Grado |
|---|---|
| Estadios I y II | |
| En los pacientes en estadios IA, IB, IIA y IIB sin contraindicación médica el tratamiento de elección es la resección quirúrgica | 1B |
| La resección sublobar se recomienda en los pacientes inoperables o con elevada comorbilidad | 1B |
| Las alternativas terapéuticas en los pacientes que rechazan la cirugía o son inoperables son la RT o la ablación por radiofrecuencia | 2C |
| La RT adyuvante no está recomendada en el estadio I | 1A |
| La QT adyuvante se recomienda en el estadio II (N1) | 1A |
| Estadio III | |
| En el estadio IIIA resecable y sin afectación N2, el tratamiento propuesto es la resección quirúrgica con QT/RT adyuvante | 1A |
| En el estadio IIIA potencialmente resecable sin afectación ganglionar N2, el tratamiento propuesto es la QT/RT neoadyuvante, resección quirúrgica y tratamiento adyuvante | 2C |
| En el estadio IIIA no resecable el tratamiento debería ser la QT/RT radical | 1A |
| En el estadio IIIA con afectación N2 intraoperatoria (oculta) el tratamiento es la resección quirúrgica y la QT/RT adyuvante | 1A/2C |
| El estadio IIIA-N2 preoperatorio el tratamiento puede ser QT/RT definitiva o terapias de inducción y cirugía | 1A |
| En el estadio IIIA-N2 preoperatorio no se recomienda la resección quirúrgica inicial y terapia adyuvante, salvo excepciones | 1C |
| Pacientes en estadio IIIB y buen estado general, el tratamiento recomendado es la QT/RT concurrente con intención curativa | 1A |
| No se recomienda la cirugía de rescate en los pacientes en estadio IIIB salvo casos muy excepcionales | 1C |
| Estadio IV | |
| El tratamiento recomendado es la poliquimioterapia | 1A |
| En los pacientes con la mutación para EGFR, la primera línea de tratamiento son los ITK | 1A |
| En pacientes muy seleccionados con metástasis cerebral y/o adrenal únicas y neoplasia resecable sin adenopatías mediastínicas se recomienda tratamiento multidisciplinario de ambas lesiones | 1B/2B |
ITK: inhibidores de la tirosin cinasa; QT: quimioterapia; QT/RT: quimiorradioterapia; RT: radioterapia.
Salvo en una revisión sistemática100, no hay estudios prospectivos aleatorizados que definan la duración, la frecuencia y el tipo de exploraciones que deben ser realizadas durante el seguimiento del CP. Aun así, debe considerarse el tratamiento de las complicaciones derivadas de los tratamientos recibidos y detectar las recidivas tumorales y/o la aparición de un segundo tumor primario. Para ello se recomienda la participación de un equipo multidisciplinar en la toma de decisiones durante el seguimiento. Puesto que la mayoría de las recaídas se producen durante los 2-3 primeros años tras el tratamiento, se recomiendan revisiones cada 3 o 6 meses y posteriormente una vez al año. Se estima que 5 años pueden ser insuficientes para considerar curado a un enfermo, sobre todo si hay afectación adenopática o vascular101.
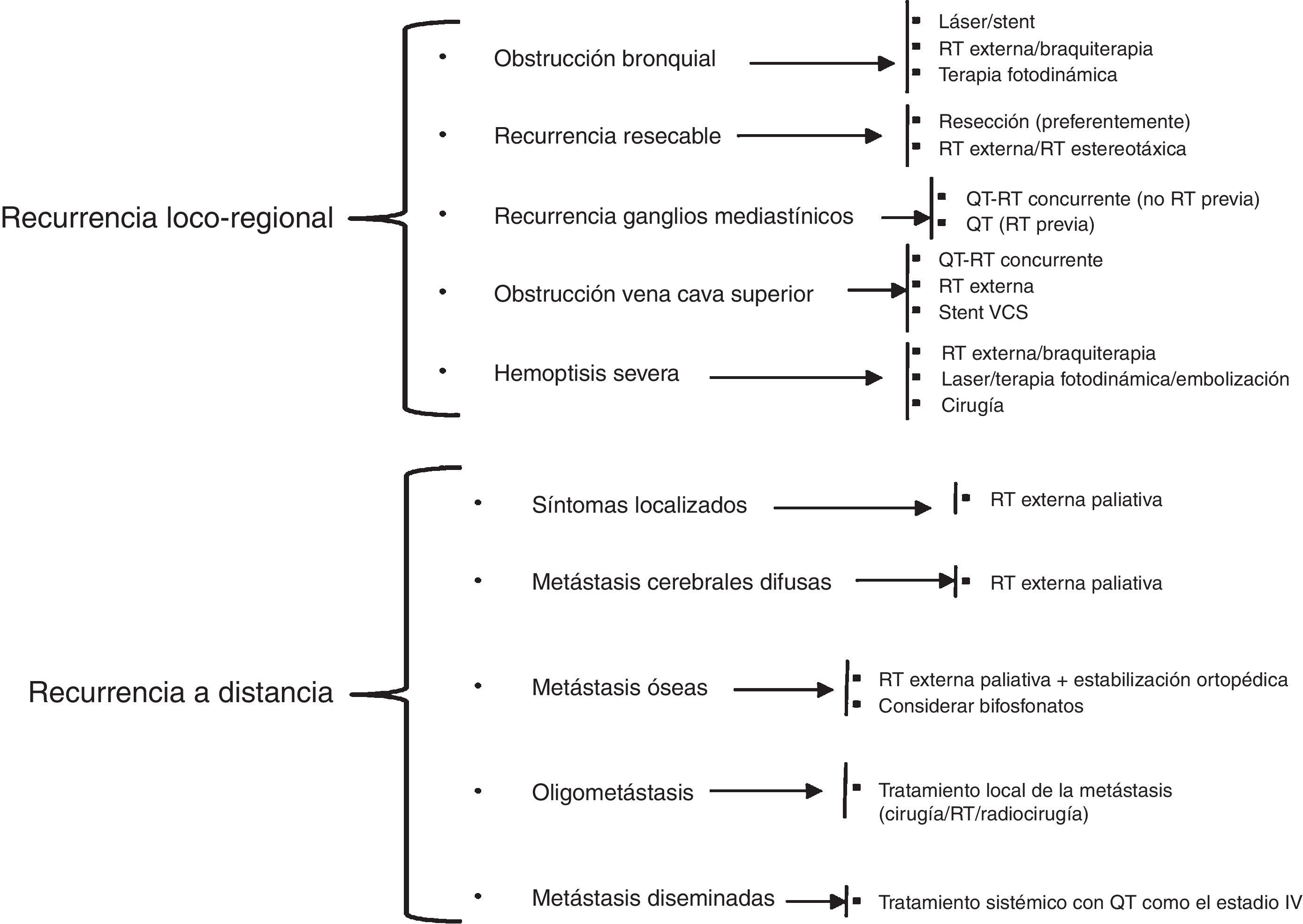
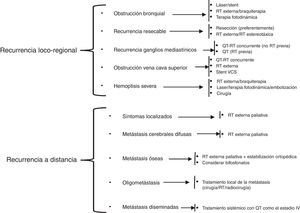
En el tratamiento de las recaídas del CPCNP es importante identificar, en un primer momento, si se trata de una recurrencia del tumor primario o si es un segundo carcinoma primario pulmonar. Las recurrencias pueden ser locorregionales o a distancia, siendo estas últimas las más frecuentes. El tratamiento de las recaídas se resume en la figura 3, según las recomendaciones de la National Comprehensive Cancer Network (NCCN)102.
Adaptación del esquema de tratamiento de la recurrencia del CPCNP de la guía de práctica clínica en oncología de la NCCN.
QT: quimioterapia; QT-RT: quimiorradioterapia; RT: radioterapia; VCS: vena cava superior.
Modificado de National Comprehensive Cancer Network102.
El derrame pleural se puede manejar con toracocentesis repetidas si los enfermos presentan mejoría de la clínica, sobre todo en pacientes con enfermedad muy avanzada y expectativa de vida limitada a corto plazo103 (grado 1C). La instilación de talco por VATS es una cirugía mínimamente invasiva y con baja morbimortalidad que permite explorar toda la cavidad pleural e instilar el talco bajo visión directa103 (grado 1C). En caso de que la pleurodesis no pueda realizarse debido a un mal estado general, corta esperanza de vida o falta de reexpansión pulmonar postevacuación, se puede introducir un catéter de manera permanente, permitiendo su manejo ambulatorio103 (grado 1C).
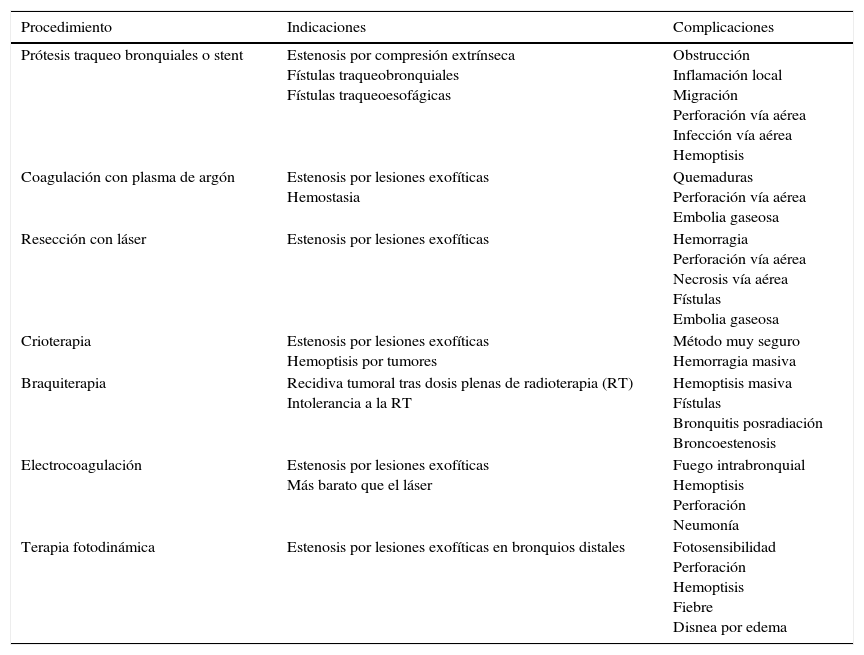
Las indicaciones y las complicaciones de los principales tratamientos paliativos endoscópicos están resumidas en la tabla 3. En un CP en estadio avanzado con una obstrucción sintomática de la vía aérea se recomienda el tratamiento broncoscópico mediante desbridamiento mecánico, ablación tumoral o colocación de endoprótesis104 (grado 1C). En la fístula traqueo-esofágica se recomienda la doble colocación de endoprótesis metálicas autoexpandibles en esófago y vía aérea, o solamente en esófago (grado 1B).
Resumen tratamientos endoscópicos paliativos en carcinoma broncogénico
| Procedimiento | Indicaciones | Complicaciones |
|---|---|---|
| Prótesis traqueo bronquiales o stent | Estenosis por compresión extrínseca Fístulas traqueobronquiales Fístulas traqueoesofágicas | Obstrucción Inflamación local Migración Perforación vía aérea Infección vía aérea Hemoptisis |
| Coagulación con plasma de argón | Estenosis por lesiones exofíticas Hemostasia | Quemaduras Perforación vía aérea Embolia gaseosa |
| Resección con láser | Estenosis por lesiones exofíticas | Hemorragia Perforación vía aérea Necrosis vía aérea Fístulas Embolia gaseosa |
| Crioterapia | Estenosis por lesiones exofíticas Hemoptisis por tumores | Método muy seguro Hemorragia masiva |
| Braquiterapia | Recidiva tumoral tras dosis plenas de radioterapia (RT) Intolerancia a la RT | Hemoptisis masiva Fístulas Bronquitis posradiación Broncoestenosis |
| Electrocoagulación | Estenosis por lesiones exofíticas Más barato que el láser | Fuego intrabronquial Hemoptisis Perforación Neumonía |
| Terapia fotodinámica | Estenosis por lesiones exofíticas en bronquios distales | Fotosensibilidad Perforación Hemoptisis Fiebre Disnea por edema |
En caso de hemoptisis masiva la broncoscopia identifica la fuente de sangrado, y si las lesiones son visibles esta se complementa con técnicas como la coagulación con argón plasma, Nd:YAG láser y electrocauterio (grado 1C). El tratamiento broncoscópico endobronquial está indicado ante hemoptisis leve o moderada en lesiones visibles en las vías aéreas centrales. En lesiones distales o parenquimatosas se recomienda la aplicación de RT de haz externo (grado 1C).
Conflicto de interesesEl Dr. Segismundo Solano Reina ha colaborado con GSK y Pfizer industrias farmacéuticas con interés en el campo del tratamiento del tabaquismo.
El resto de los autores declaran no tener ningún conflicto de intereses.