Introducción
Nuestros conceptos sobre los mecanismos patogénicos del asma han evolucionado significativamente en el curso de los últimos años. En 1991 se alcanzaba una definición consensuada de asma que recogía la inflamación e hiperreactividad bronquiales y la obstrucción variable al flujo en las vías respiratorias como características centrales del asma1. Este informe del National Heart, Lung and Blood Institute (NHLBI) estadounidense sirvió como plataforma para diversas iniciativas internacionales para el control del asma. En 1997, el panel de expertos del NHLBI se reunía de nuevo para emitir un informe revisado2, en el que la definición de asma no variaba en sus principios sobre el papel central de la inflamación en la patogenia de la enfermedad y se mantenía el carácter reversible de la obstrucción al flujo en las vías respiratorias como elemento característico. En consecuencia, el estudio de la patogenia del asma y su tratamiento se han enfocado extensamente en entender y controlar la inflamación de las vías respiratorias, como medio para controlar la obstrucción al flujo y los síntomas resultantes. Sin embargo, el informe del Consenso de 1997 añadía una modificación del concepto de "reversibilidad" de las alteraciones de la función pulmonar, reseñándose la existencia de observaciones que apuntaban al posible desarrollo de alteraciones pulmonares persistentes. Se introducía por primera vez el concepto de "remodelación de las vías respiratorias" para referirse a cambios estructurales que ocurren en asociación con la inflamación crónica y que "pueden no ser completamente reversibles". El mismo informe indicaba la necesidad de investigaciones futuras en esta dirección. Los avances subsiguientes reforzaron y generalizaron la importancia de la remodelación de las vías respiratorias en la patogenia del asma. De hecho, la forma de entender la fisiopatología de esta enfermedad ha evolucionado de forma rápida y sustancial. De considerar que los episodios de broncospasmo, hipersecreción mucosa y edema, caracterizados por su reversibilidad, eran alteraciones definitorias, y de la proposición de que anormalidades intrínsecas del músculo liso bronquial eran sustrato de la enfermedad, se ha pasado a entender que la remodelación estructural de las vías respiratorias participa de un modo importante en los mecanismos de la hiperreactividad bronquial, la obstrucción episódica al flujo y, finalmente, el deterioro progresivo de la función pulmonar. La actualización más reciente del Consenso por el panel del NHLBI3, del año 2002, destaca la existencia de pacientes asmáticos con limitación persistente del flujo en las vías respiratorias "para la que no se ha encontrado tratamiento efectivo", y reconoce la existencia de un cambio de paradigma sobre el asma, que conceptualmente se ha expandido desde el broncospasmo y la inflamación hacia la remodelación de las vías respiratorias. La revisión más reciente del Consenso Canadiense sobre el Asma del Adulto4, del año 2004, ha incorporado a la propia definición de asma que "la inflamación y sus efectos resultantes sobre la estructura de las vías respiratorias se consideran los mecanismos principales que conducen al desarrollo y mantenimiento del asma".
El concepto de remodelación de las vías respiratorias ha transformado de forma definitiva nuestra percepción sobre la patogenia del asma. Sin embargo, no ha trascendido aún a las directrices de decisión terapéutica y seguimiento. No se ha alcanzado aún conocimiento suficiente sobre los posibles efectos que los tratamientos disponibles podrían tener sobre la remodelación de las vías respiratorias. Tampoco han llegado al arsenal clínico nuevas estrategias terapéuticas enfocadas a los mecanismos biológicos de la remodelación tisular. Lo que se puede hacer para modificar el remodelado bronquial en el asma está de momento en manos de la investigación, y se están añadiendo a gran velocidad nuevos datos sobre sus mecanismos biológicos y los efectos de intervenciones experimentales.
Consecuencias de la remodelación de las vías respiratorias
La remodelación de las vías respiratorias incluye cambios estructurales (revisados extensamente por Bousquet et al)5 tales como hiperplasia epitelial con incremento del número de células caliciformes productoras de moco, fibrosis subepitelial, incremento de la cantidad de músculo liso corregida por el tamaño de la vía respiratoria (concepto al que se refiere el término "masa de músculo liso"), incremento del número y tamaño de las glándulas mucosas, angiogénesis bronquial y, en conjunto, engrosamiento de la pared de la vía respiratoria. Se cree actualmente que estos cambios subyacen a los síntomas y signos del asma y su evolución3,4. Sin embargo, el arsenal terapéutico actual no está enfocado directamente sobre la remodelación de las vías respiratorias. En consecuencia, no "cura" el asma y no siempre permite alcanzar un control satisfactorio del asma difícil. Es razonable que el desarrollo de tratamientos futuros que aborden el control del asma, desde la posibilidad de detener tempranamente su evolución hasta el logro de un mejor manejo del asma grave, se dirija al menos en parte hacia dianas terapéuticas hacia las que la investigación sobre los mecanismos de la remodelación deberá apuntar.
Los mecanismos celulares y moleculares responsables de la remodelación de las vías respiratorias envuelven múltiples subsistemas en interacción compleja, donde intervienen factores de crecimiento, citocinas y otros mediadores inflamatorios, receptores celulares, vías de señalización intracelular, sistemas de regulación de la respuesta inmunitaria, regulación del ciclo celular y apoptosis, regulación de la expresión genética y diferenciación celular, y participación de células madre pluripotenciales. La investigación en ciencia básica es extremadamente activa en este campo y cada mes se aporta nueva información. El conocimiento conseguido hasta la fecha es parcial, insuficientemente integrado y no exento de paradojas. Además, están surgiendo nexos interesantes entre el fenómeno de la remodelación de las vías respiratorias y mecanismos implicados en el desarrollo y la reparación frente a la neoplasia, así como una noción incipiente de nuevas formas de comunicación bidireccional entre el sistema inmunitario adaptativo y las células estructurales de los tejidos6. En conjunto, los datos aportados hasta el momento han permitido entender la remodelación de las vías respiratorias como un fenómeno de reparación mal regulada, donde se engranan y alteran mecanismos efectores y reguladores de lesión, inflamación, reparación y resolución (fig. 1). La evidencia proporcionada por múltiples estudios indica que en el origen del asma (al menos en el origen que resulta visible actualmente) participan interacciones aún poco definidas entre las líneas innata y adaptativa del sistema inmunitario y, como resultado común, una respuesta inmunitaria adaptativa conducida por células efectoras T CD4+, con fenotipo predominante de activación tipo T helper 2, definido por su secreción de citocinas. Poco conocidos son los fallos de regulación que contribuyen al sostenimiento indefinido de esta respuesta inmunitaria y la inflamación crónica resultante. Los mediadores liberados por células inmunitarias residentes y reclutadas ejercen directamente acciones fibrogénicas y mitogénicas sobre células mesenquimales de la pared de la vía respiratoria y tienen, por otra parte, la capacidad de producir lesiones en el epitelio bronquial y bronquiolar. La presencia de lesión epitelial desencadena a su vez inflamación, como respuesta que fisiológicamente sería protectora y ayudaría a organizar la reparación y su resolución. En el epitelio lesionado se origina una respuesta proliferativa que contribuye a guiar, mediante factores de crecimiento y fibrogénicos, el componente mesenquimal subepitelial de la reparación. En este contexto, las células estructurales de la pared de la vía respiratoria también pueden segregar citocinas y otros mediadores de la inflamación. Se cierran de esta manera distintos círculos posibles de retroalimentación donde probablemente no existe un esquema causa-efecto único.
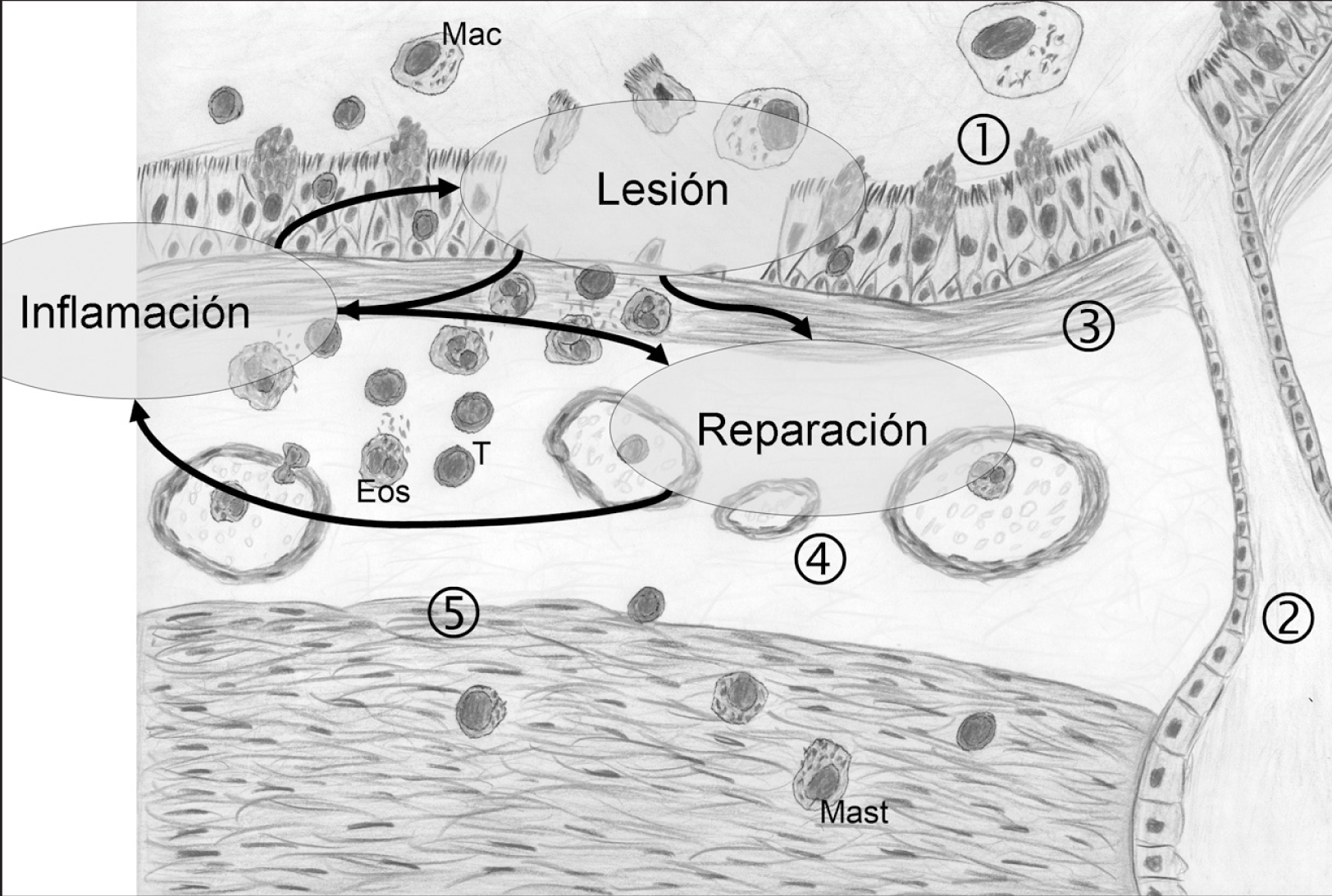
Fig. 1. Remodelación de las vías respiratorias. En la patogenia del asma, "extrínseca" o "intrínseca", subyace una respuesta inmunitaria celular que induce inflamación crónica y se observa en asociación con alteraciones de la unidad trófica epiteliomesenquimal en la pared de la vía respiratoria, aunque la secuencia de hechos es controvertida. Esta asociación desencadena mecanismos similares a los conocidos en las respuestas reparativas, aunque de forma disregulada y sostenida, lo que origina cambios estructurales ("remodelación"). Esto incluye hiperplasia epitelial con incremento del número de células caliciformes(1), aumento del número y tamaño de las glándulas mucosas (2), fibrosis subepitelial(3), angiogénesis(4)e hiperplasia/hipertrofia del músculo liso(5). Algunos mediadores liberados por las células inflamatorias son lesivos, mientras que otros inducen hiperplasia y fibrosis "reparadoras". Las células estructurales activadas en este proceso pueden liberar mediadores proinflamatorios. De este modo se cierran posibles bucles de autoperpetuación entre inflamación, lesión y reparación. Su mejor conocimiento podrá desvelar nuevas dianas terapéuticas.Mac: macrófagos; T: células T CD4+; Eos: eosinófilos; Mast: mastocitos.
A pesar de la complejidad y del conocimiento limitado de los mecanismos que originan la remodelación de las vías respiratorias, las consecuencias de ésta parecen comprenderse relativamente mejor. Un componente particularmente destacado de la remodelación de las vías respiratorias es el crecimiento anormal del músculo liso, causado al menos en parte por hiperplasia, y la resultante "masa de músculo liso" incrementada. El crecimiento del músculo liso en el asma está extensamente documentado en humanos y se ha reproducido en modelos animales de la enfermedad basados en sensibilización alérgica y broncoprovocación repetida. Los primeros datos sobre el engrosamiento del músculo liso de las vías respiratorias en el asma se remontan a 19227. Más recientemente, y a través de métodos de morfología cuantitativa mejor desarrollados y normalizados, se ha consolidado el concepto del incremento de la masa de músculo liso bronquial en humanos asmáticos8-14. En animales, los datos obtenidos mediante modelos experimentales han permitido asociar el crecimiento de la masa de músculo liso con el grado de reactividad de las vías respiratorias frente a agonistas colinérgicos, o las respuestas de las vías respiratorias tras broncoprovocación con alérgeno15-20. Estudios basados en modelación de la mecánica de las vías respiratorias han indicado que un incremento de la masa del músculo liso a base de músculo con propiedades contráctiles normales puede ser suficiente por sí mismo para causar hiperreactividad bronquial frente a estímulos contráctiles21-24. Además, el engrosamiento submucoso debido a fibrosis subepitelial y edema25, y la reducción de la interdependencia mecánica entre vía respiratoria y parénquima debida al engrosamiento de la adventicia26 son factores que contribuyen a aumentar el efecto constrictivo que sobre la vía respiratoria tiene un grado determinado de acortamiento del músculo liso. De acuerdo con estos modelos, incrementos moderados del grosor de la pared de la vía respiratoria, sin efecto relevante sobre la resistencia basal al flujo, pueden tener un efecto dramático sobre el estrechamiento de la vía respiratoria causado por un acortamiento "normal" del músculo liso frente a un estímulo. En conjunto, las observaciones en humanos asmáticos, los datos experimentales obtenidos en modelos animales y las deducciones de la modelación matemática han introducido el concepto de que la remodelación de las vías respiratorias, y en particular el incremento de la masa de músculo liso, es un mecanismo fundamental de la hiperreactividad bronquial.
¿Cuándo empieza la remodelación de las vías respiratorias?
El conocimiento de la historia natural de la remodelación de las vías respiratorias en el asma está limitado por el hecho de que, a falta de procedimientos suficientemente validados para su estudio no invasivo en humanos, la única fuente directa de datos es la biopsia bronquial endoscópica. Incluso la información proporcionada por ésta es limitada, dada la dificultad relativa de obtener muestras parciales de músculo liso que permitan realizar estimaciones cuantitativas de su masa. De hecho, muchos de los estudios basados en biopsia bronquial se han centrado en el aspecto fibrótico de la remodelación, mediante la medición del incremento de grosor de la lamina reticularis subepitelial. Otro inconveniente es que la historia natural de la remodelación de las vías respiratorias y el asma puede ser de comienzo infantil, incluso probablemente en parte de los casos en los que la enfermedad se hace manifiesta en la edad adulta. La accesibilidad de la población infantil para fines de investigación clínica y las cuestiones éticas obviamente asociadas limitan el estudio directo de la remodelación mediante biopsia precisamente en el segmento de edad en que la información obtenida podría ser más útil para optimizar las directrices de control del asma, así como para evaluar intervenciones terapéuticas que podrían resultar importantes en niños con asma de difícil manejo. Por su parte, los estudios post mortem aportaron información preliminar descriptiva que contribuyó de forma significativa al establecimiento del concepto de la remodelación de las vías respiratorias, pero sus evidentes limitaciones dejan a este tipo de estudios prácticamente exangües para las necesidades actuales. A pesar de estas dificultades, ha sido posible acumular datos clínicos que permiten delinear la trayectoria de la remodelación de las vías respiratorias desde edades tempranas. En un estudio en el que se siguió a una cohorte aleatoria de recién nacidos, la detección de la hiperreactividad bronquial frente a histamina al mes de edad fue predictora, antes de que muchos factores medioambientales pudiesen intervenir, de la incidencia acumulada de asma y deterioro de la función pulmonar a los 6 años de edad27. En otro estudio longitudinal, de largo seguimiento, la hiperreactividad bronquial en la infancia fue predictora de asma en la edad adulta28. Otros estudios aportaron evidencia directa de remodelación de las vías respiratorias a edad infantil. A los 9 años de edad, 9 de 10 niños con asma moderada mostraron evidencia histopatológica de remodelación bronquial en la biopsia29. Payne et al30 obtuvieron biopsia bronquial de 19 niños de entre 6 y 16 años de edad con asma difícil, y 10 niños sin asma que requirieron broncoscopia para fines diagnósticos varios. El grupo de niños con asma mostró un engrosamiento de la lamina reticularis de magnitud similar a la observada en un grupo adicional de adultos asmáticos. En otro estudio en el que se obtuvo biopsia de niños con asma grave se encontró, además del engrosamiento de la lamina reticularis, crecimiento hiperplásico del músculo liso31. Otra cuestión, aparte del inicio de la remodelación de las vías respiratorias, es su comportamiento en los sujetos asmáticos en quienes se resuelven los síntomas. Parte de los sujetos con asma en remisión clínica, tanto niños libres de síntomas durante 1 año32 como adultos tras 2 años33, continúan presentando hiperreactividad bronquial y evidencia de remodelación de las vías respiratorias en la biopsia34. La remisión "verdadera" del asma debería por tanto definirse no por la desaparición (incluso sostenida) de síntomas, sino por la ausencia de signos de inflamación y remodelación en las vías respiratorias. Esto se ha observado solamente entre el 10 y el 15% de una cohorte de asmáticos atópicos en remisión sintomática34,35. Estas observaciones apuntan a que la persistencia en asmáticos de la remodelación de las vías respiratorias más hiperreactividad bronquial como probable consecuencia directa es coherente con datos experimentales obtenidos en animales. En ratones con sensibilidad alérgica a la ovoalbúmina y broncoprovocación repetida con este antígeno, la interrupción del protocolo experimental de broncoprovocaciones se siguió de la resolución de la inflamación. Sin embargo, la remodelación de las vías respiratorias acompañada de hiperreactividad bronquial a la metacolina persistió a largo plazo, disociada de la inflamación18. En otro estudio, se bloqueó mediante un antagonista soluble la interleucina-13, una citocina producida principalmente por células T CD4+ tipo T helper 2 activadas y definida como de importancia central en la génesis de la hiperreactividad bronquial. El bloqueo de esta citocina mediante el antagonista suministrado desde el inicio del protocolo de broncoprovocación repetida fue efectivo a la hora de prevenir el desarrollo de remodelación e hiperreactividad a la metacolina. Sin embargo, la introducción del antagonista en ratones con remodelación ya establecida fue incapaz de revertirla y de resolver la hiperreactividad36. Estos datos apuntan a que la inflamación desempeña un papel esencial en la inducción inicial de la remodelación de las vías respiratorias, pero remodelación e hiperreactividad pueden seguidamente persistir en ausencia de inflamación. Este concepto puede ser relevante a la hora de diseñar posibles estrategias para tratar o prevenir la remodelación mediante tratamientos que principalmente combaten la inflamación, como es el caso de los esteroides inhalados.
En conjunto, estos estudios, complementados con otros datos publicados sobre el declive de la función pulmonar espirométrica, indican que la remodelación de las vías respiratorias: a) se inicia tempranamente en el curso de la enfermedad y puede preceder a los síntomas; b) condiciona la evolución futura de la función pulmonar y la probabilidad de desarrollar asma grave; c) puede persistir junto con la hiperreactividad bronquial en los asmáticos con remisión de síntomas, y d) condiciona la probabilidad de que los sujetos en "remisión" desarrollen en el futuro síntomas y complicaciones.
Intervenciones experimentales sobre la remodelación de las vías respiratorias. ¿Estamos tratando la remodelación?
Según las directrices internacionales actuales para el manejo del asma, el tratamiento antiinflamatorio se introduce y ajusta de acuerdo con la evaluación de los síntomas y la función pulmonar, bajo el concepto de mejorar o eliminar dichos síntomas mediante el control de la inflamación bronquial si los agentes broncodilatadores no resultan suficientes en un primer escalón. Sin embargo, dados los conceptos actuales sobre la patogenia del asma, parece razonable que las guías para el tratamiento y seguimiento de los asmáticos se basen, al menos en parte, en la monitorización de la remodelación de las vías respiratorias. Dada la evidencia, aportada desde distintos ángulos, de que la remodelación de las vías respiratorias desempeña un papel central en el mecanismo de la hiperreactividad bronquial, es posible que la medición cuantitativa de ésta proporcione un valioso indicador no invasivo que permita "guiar según la remodelación" el manejo del asma con los tratamientos disponibles o futuros. Sont et al37 sometieron a prueba esta hipótesis mediante un ensayo clínico en el que compararon el ajuste del tratamiento con corticoides inhalados según las directrices existentes ("estrategia de referencia") con otro grupo de sujetos en el que se empleó el grado de reactividad bronquial como guía adicional para el ajuste de la medicación. Se realizó broncoscopia con toma de biopsias bronquiales en el momento de la incorporación de los sujetos al estudio y al cabo de 2 años de intervención mediante una estrategia o la otra. El ajuste de los corticoides inhalados según la hiperreactividad bronquial dio lugar a un mejor control del asma, con una reducción de la frecuencia de exacerbaciones, mejoría comparativa de la función pulmonar y reducción del grosor de la lamina reticularis subepitelial en la biopsia. Esta evidencia histopatológica de regresión de la remodelación se observó exclusivamente en el grupo tratado según la hiperreactividad bronquial, en el que el grosor de la lamina reticularis a la salida del estudio fue inferior al basal, mientras que en los sujetos del grupo de referencia permaneció igual. Estos resultados indican que las directrices actuales para el manejo del asma pueden conducir a un control subóptimo de la enfermedad en al menos una porción de los pacientes asmáticos, que se puede identificar a dichos pacientes mediante medición de la hiperreactividad bronquial y que ésta puede servir de guía para un mejor control del asma basado en la prevención o cierta reversión de la remodelación. En concordancia con los datos experimentales obtenidos en modelos animales y con el ensayo clínico de Sont et al37, otros estudios han apoyado el concepto de que el grado de reactividad bronquial frente a la metacolina no está necesariamente asociado con el grado de inflamación de las vías respiratorias evaluado en esputo inducido, lavado broncoalveolar o biopsia bronquial38, pero sí con el grado de remodelación medido en la biopsia39,40. El estudio de Sont et al se siguió de otros ensayos clínicos en los que se evaluaron conjuntamente el grado de reactividad bronquial y el de la remodelación mediante biopsia. Hoshino et al41 compararon la administración de beclometasona dipropionato frente a placebo en una muestra de 32 asmáticos que nunca habían recibido tratamiento esteroideo y entre los que había 7 sujetos sin evidencia de atopia. El tratamiento con beclometasona indujo mejoría de la hiperreactividad bronquial asociada a disminución del grosor de la lamina reticularis, así como disminución de la expresión de la metaloproteinasa de matriz tipo 9 e incremento del inhibidor tisular de la metaloproteinasa tipo 1, una combinación que se considera marcador bioquímico de la remodelación. En otro estudio, el tratamiento sostenido con fluticasona condujo a largo plazo a una mejoría de la hiperreactividad bronquial asociada a reversión de la remodelación bronquial42. Englobando este tipo de resultados en un contexto amplio, un estudio epidemiológico extenso y de largo seguimiento asoció el uso sostenido de dosis bajas de corticoides inhalados con una disminución de la mortalidad por asma43.
Sin embargo, la capacidad de los corticoides inhalados para revertir aspectos de la remodelación de las vías respiratorias no está exenta de discrepancias. En un estudio en adolescentes con remisión sintomática del asma, la prolongación del tratamiento con budesonida no consiguió disminuir su grado de hiperreactividad bronquial44. Este hecho se atribuyó a remodelación bronquial irreversible, aunque ésta no se analizó directamente, y el seguimiento fue sólo de 9 meses. Por su parte, los modelos animales inducen a pensar que los corticoides inhalados tienen la capacidad de prevenir la remodelación de las vías respiratorias, pero no de revertirla cuando ya está establecida. En el modelo de asma experimental en rata, el propionato de fluticasona fue efectivo para prevenir el desarrollo de hiperreactividad bronquial y remodelación de las vías respiratorias si se administraba desde el comienzo de un protocolo de broncoprovocaciones repetidas con alérgeno45,46. Sin embargo, no lo fue a la hora de revertir la remodelación e hiperreactividad ya establecidas si se introducía a partir del final del protocolo de broncoprovocaciones45.
Aparte del tema abierto sobre la capacidad de los corticoides inhalados para tratar la remodelación e hiperreactividad bronquial existentes, un punto quizá de mayor interés práctico es su capacidad para evitarlas si se introducen de forma temprana, en una estrategia de manejo del asma distinta del esquema escalonado que contemplan las directrices actuales. Los datos de modelos experimentales señalan que diversas intervenciones terapéuticas con eficacia "antirremodeladora" temprana pueden no ser efectivas en estadios posteriores36,45. El ensayo clínico de Sont et al37 y los subsiguientes41,42 permiten conjeturar que el empleo temprano del grado cuantitativo de hiperreactividad bronquial como parámetro de guía para el ajuste terapéutico podría permitir, a medio y largo plazo, reducciones de las dosis de medicación esteroidea requeridas. En un estudio sobre pacientes con asma leve de nuevo diagnóstico, la introducción temprana --pero no la tardía-- de budesonida condujo a un mejor control ulterior de la enfermedad y permitió mantener un grado bajo de reactividad bronquial con dosis reducidas de mantenimiento47.
Aparte de los corticoides inhalados, los efectos de otros tratamientos se han evaluado mucho menos mediante ensayos clínicos. El salmeterol en solitario, pero no la fluticasona, redujo en un ensayo de 3 meses de duración el grado de hipervascularización de la vía respiratoria, un parámetro de remodelación48. Datos obtenidos en el modelo de asma experimental en la rata son, sin embargo, controvertidos acerca de un posible efecto paradójico de la combinación de salmeterol con fluticasona49. Esta combinación redujo la hiperplasia de células caliciformes productoras de moco, pero potenció la fibrosis subepitelial. Mientras que el salmeterol en solitario no tuvo efecto sobre este tipo de cambios estructurales, su combinación con fluticasona anuló el efecto que ésta mostró en solitario en cuanto a reducción del depósito subepitelial de fibronectina e incrementó el depósito de colágeno.
Perspectiva futura
La activa investigación actual sobre la remodelación de las vías respiratorias en el plano de la ciencia básica está ofreciendo oportunidades múltiples para el hallazgo de nuevas dianas terapéuticas, guiado por el conocimiento de mecanismos. Existen actualmente algunas intervenciones orientadas al control de la remodelación, cuyos efectos se están estudiando en laboratorio. El beneficio potencial es considerable porque las nuevas intervenciones terapéuticas podrían tener aplicaciones de interés más allá de la remodelación de las vías respiratorias y el asma. No obstante, los retos son también importantes. El camino se prevé largo para que nuevas intervenciones, la mayoría de las cuales se encuentran actualmente en fase de descubrimiento o de desarrollo preclínico incipiente, lleguen a incorporarse al arsenal terapéutico validado para aplicación clínica.
Un aspecto diferente de la posibilidad de modificar el remodelado bronquial en el asma, probablemente no menos importante y de beneficio más tangible a un plazo más corto, es el desarrollo de una nueva estrategia de manejo de la enfermedad con los tratamientos existentes. Hace 2 décadas, el tratamiento del asma se centraba en la broncodilatación y se pasaba por alto la importancia de la inflamación de las vías respiratorias, a pesar de que ésta era ya conocida. Las directrices actuales son el producto de implementar una cuidadosa estrategia escalonada de tratamiento centrada principalmente en el control de la inflamación. Sin embargo, la monitorización de ésta no forma parte de los criterios para el ajuste del tratamiento y seguimiento de los asmáticos, algo que constituye una carencia elemental de feedback si el objetivo es el "control" de la inflamación, y conociéndose que los síntomas y función pulmonar no necesariamente reflejan la actividad inflamatoria en las vías respiratorias (¿contamos con una definición de "remisión" del asma?). Ni siquiera está claro el efecto que ajustar el tratamiento "según la inflamación" tiene sobre el deterioro de la función pulmonar a largo plazo en los asmáticos, y algunos estudios en humanos y modelos animales señalan la posibilidad de una disociación entre inflamación y remodelación tras la inducción de ésta. ¿Cuál sería el efecto de manejar el asma tomando como guía indicadores de la remodelación de las vías respiratorias? El conocimiento aportado recientemente por diversos estudios indica que el manejo del asma debería estar guiado, al menos en parte, por la evaluación de la remodelación, pero hasta la fecha la hiperreactividad bronquial y la remodelación no se han tenido en cuenta para la formulación de directrices. En este sentido, la introducción anticipada de medicación esteroidea inhalada y su combinación con el empleo del grado de reactividad bronquial como criterio para el ajuste individualizado de las dosis pueden constituir un avance obvio y accesible hacia un mejor manejo del asma a largo plazo. Se necesita asimismo comprobar mejor el beneficio del tratamiento prolongado con corticoides en los sujetos con asma en remisión sintomática pero con evidencia de enfermedad subclínica en forma de remodelación e hiperreactividad bronquial. Los ensayos clínicos que ya han dado pasos en estas direcciones deberían ser la base de nuevos estudios que permitiesen consolidar criterios y confirmar la pertinencia de una revisión de directrices. Los datos ya aportados indican que, sin necesidad de aguardar la llegada de soluciones nuevas, la optimización, aún posible, del manejo del asma podría contribuir a disminuir la necesidad de tratar el asma difícil.
A medida que se introduzcan nuevos tratamientos, o se avance hacia una necesidad ya anticipable de modificaciones en las directrices para el manejo del asma, se precisará en los ensayos clínicos la obtención de mediciones fiables de indicadores cuantitativos de remodelación. La biopsia bronquial ya se ha utilizado a estos efectos de forma segura, ha proporcionado valiosísima información para nuestro conocimiento actual sobre la remodelación y su comportamiento, y será con toda probabilidad ineludible en ensayos clínicos futuros en los que será esencial evaluar el efecto de nuevos tratamientos o nuevas estrategias para establecer directrices. Más allá de la finalidad investigadora, es previsible la necesidad de desarrollar y validar indicadores de la remodelación que sean lo más directos posible, pero no invasivos, para su uso en la práctica clínica según potenciales directrices futuras. La cuantificación de la reactividad bronquial a la metacolina ya ha empezado a desempeñar un interesante papel en este sentido. Otros estudios se están centrando en el campo de las técnicas de imagen. La tomografía axial computarizada de alta resolución ha permitido detectar en asmáticos un incremento del grosor de la pared de la vía respiratoria y hallar su correlación histopatológica con el incremento del grosor de la lamina reticularis en la biopsia bronquial50. La tomografía de coherencia óptica y ecografía endobronquial, técnicas que podrían permitir la obtención de secciones ópticas de la pared de la vía respiratoria mediante broncoscopia sin biopsia, se están considerando.
Correspondencia: Dr. D. Ramos-Barbón.
Unidad de Investigación. Complejo Hospitalario Universitario Juan Canalejo. Anexo-Hospital Materno-Infantil.
As Xubias de Arriba, 84. 15006 A Coruña. España.
Correo electrónico: david.ramos-barbon@canalejo.org